题目内容
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
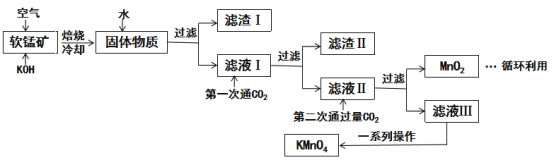
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
K2MnO4+H2O,该反应配平后MnO2与O2的化学计量数比为________。采用对空气加压的方法可以提高MnO2的利用率,原因是_________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀硫酸代替的原因是_____________。
(3)第二次通入过量的CO2生成MnO2的离子方程式为___________________。
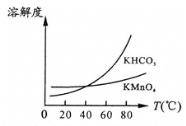
(4)由图可知,从滤液Ⅲ得到KMnO4需经过__________________、洗涤等操作。
【答案】2:1 加压增大氧气的浓度,反应速率加快,使MnO2反应更充分 Al(OH)3、H2SiO3 不易控制硫酸的用量,过量的硫酸会使 Al(OH)3溶解(或酸性过强会使K2MnO4过早歧化) 3MnO42- + 4CO2 + 2H2O = MnO2↓+ 2MnO4- + 4HCO3- 蒸发结晶,趁热过滤
【解析】
软锰矿主要成分MnO2与KOH混合在空气中焙烧,冷却得到固体物质,溶于水过滤得到滤渣I和滤液I,滤液I中应含有K2SiO3,KAl(OH)4、K2MnO4等溶质,滤渣I为Fe2O3;向滤液I中第一次通入CO2与K2SiO3、KAl(OH)4发生反应,过滤得到滤渣Ⅱ和滤液Ⅱ,滤渣Ⅱ为Al(OH)3、H2SiO3;滤液Ⅱ含有KHCO3,K2MnO4等溶质;向滤液Ⅱ中第二次通入过量CO2,再次过滤得到滤液Ⅲ和MnO2,滤液Ⅲ中含有KMnO4和KHCO3,再经过一系列操作得到较纯的KMnO4,MnO2可以循环利用。
(1)焙烧时MnO2与KOH在空气中O2的作用下反应得到K2MnO4和H2O,反应为氧化还原反应,Mn化合价升高2,O化合价降低2,根据电子转移数守恒,所以在MnO2前面配上2,O2前面配上1,根据Mn元素守恒,在K2MnO4前面配上系数2,再根据K元素守恒,在KOH前面配上4,最后根据H元素守恒,在H2O前面配上2,2MnO2+4KOH+O2![]() 2K2MnO4+2H2O。该反应配平后MnO2与O2的化学计量数比为2:1,采用对空气加压的方法可以提高MnO2的利用率,原因是加压增大氧气的浓度,反应速率加快,使MnO2反应更充分。
2K2MnO4+2H2O。该反应配平后MnO2与O2的化学计量数比为2:1,采用对空气加压的方法可以提高MnO2的利用率,原因是加压增大氧气的浓度,反应速率加快,使MnO2反应更充分。
(2)滤渣Ⅱ是Al(OH)3、H2SiO3;,第一次通CO2不能用稀硫酸代替,这是由于稀硫酸酸性强,可溶解Al(OH)3,不易控制稀硫酸的用量,溶液中便会再次混入Al3+;
(3)第二次通入过量CO2生成MnO2,溶液中原先是K2MnO4,第二次通入过量的CO2时发生歧化反应生成MnO2和KMnO4,此时CO2被转化为HCO3-,反应为氧化还原反应,则反应的离子方程式为:3MnO42-+4CO2+2H2O=MnO2↓+2MnO4-+4HCO3-。
(4)将滤液Ⅲ进行一系列操作得KMnO4,此时溶液中还存在KHCO3,根据溶解度随温度变化的图象分析,随着温度升高,二者溶解度均不断增大,在40℃附近时二者溶解度相等,超过这一温度时,KHCO3溶解度不断增大,KMnO4溶解度则增大较缓慢,所以从溶液中提取较纯的KMnO4,需要蒸发结晶,趁热过滤,洗涤等操作。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
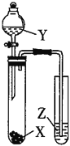
53天天练系列答案【题目】下列实验操作能达到实验目的的是
选项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z |
| ||
A | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
B | 石灰石 | 浓盐酸 | Na2SiO3溶液 | C元素非金属性大于Si元素 | |
C | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
D | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 | |
A.AB.BC.CD.D