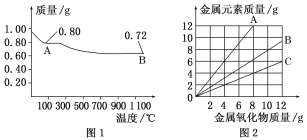
题目内容
【题目】(1)下列物质中:①MgCl2 ②金刚石 ③Na2O2 ④H2O ⑤NaCl ⑥Ne ⑦H2SO4 ⑧NH4Cl ⑨CO2 ⑩O2
只含离子键的是_______________,只含共价键的是_______________,
既含离子键又含共价键的是_______________,不存在化学键的是______________,
属于离子化合物的是______________,属于共价化合物的是____________________。
(2)已知拆开1 mol H—H键、1 mol N≡N键、1 mol N—H键分别需要吸收的能量为436 kJ、946 kJ、391 kJ,则1 mol NH3分解为N2和H2时,该反应需要___________(填“放出”或“吸收”)______kJ的热量。
(3)将1 mol N2和3 mol H2充入密闭容器中,在一定条件下发生反应N2+3H2![]() 2NH3,下列说法正确的是________。
2NH3,下列说法正确的是________。
a.最终生成2 mol NH3b.可逆反应达到平衡时,反应停止
c.当v正(H2)=v逆(N2)时,反应达到平衡
d.达到平衡时,反应达到了最大限度
e.平衡时各组分的物质的量一定相等
【答案】①⑤ ②④⑦⑨⑩ ③⑧ ⑥ ①③⑤⑧ ④⑦⑨ 吸收 46 d
【解析】
(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,由此分析解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算:焓变=反应物总键能生成物的总键能,以此计算反应热并判断吸热还是放热;
(3)根据化学平衡的特征进行分析。
(1)①MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
②金刚石中C原子之间只存在共价键,为单质;
③Na2O2中钠离子与过氧根离子之间存在离子键,氧氧之间存在非极性键,是离子化合物;
④H2O 中只存在共价键,为共价化合物;
⑤NaCl中钠离子和氯离子之间存在离子键,为离子化合物;
⑥Ne为单原子分子,不存在化学键;
⑦H2SO4中原子之间只存在共价键,为共价化合物;
⑧NH4Cl中铵根离子和氯离子之间存在离子键,N原子和H原子之间存在共价键,为离子化合物;
⑨CO2中C原子和O原子之间存在共价键,为共价化合物;
⑩O2中O原子之间只存在共价键,为单质;
所以只含离子键的是①⑤,只含共价键的是②④⑦⑨⑩; 既含离子键又含共价键的是③⑧,不存在化学键的是⑥,属于离子化合物的是①③⑤⑧,属于共价化合物的是④⑦⑨;
(2)在反应2NH3N2+3H2中,反应掉2mol NH3,共断裂6mol NH键,吸收的能量为:6×391kJ=2346kJ,生成3mol HH键、1mol N≡N键共放出的能量为:3×436kJ+946kJ=2254kJ,吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2346kJ2254kJ=92kJ,所以当1molNH3分解吸收热量为46kJ;
(3)a.可逆反应不可能完全转化,所以最终生成NH3的物质的量小于2 mol,故a错误;
b.化学平衡状态是动态平衡,达到平衡时,反应没有停止,故b错误;
c.用不同物质表示的化学反应速率之比等于化学计量数之比,则v正(H2)=3v正(N2),当v正(H2)=v逆(N2)时,3v正(N2)=v逆(N2),反应没有达到平衡,故c错误;
d.反应达到了最大限度时即为达到平衡状态,故d正确;
e.平衡时同种物质的正逆反应速率相等,各组分的物质的量保持不变,但不一定相等,故e错误;答案选d。

 阅读快车系列答案
阅读快车系列答案【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )
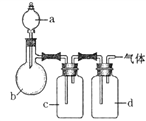
选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是
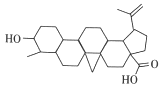
选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D