题目内容
【题目】A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,A的某种原子无中子,B的最外层有3个成单电子,C与A可形成1:1和1:2的化合物且常温下呈液体,D的原子半径是短周期中最大的,F的最高价氧化物对应水化物是最强的含氧酸,C和E形成的氧化物有两性,G的最高能层符号为N, 且其内层的d轨道电子数与最外层电子数相等。

(1)G原子的价电子排布式为_____________。
(2)BA3的VSEPR模型为_____________。
(3)离子半径C2->D+,原因是_____________。
(4)E与F形成的化合物EF3 在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为_____________(标明配位键),其中该蒸气分子中E原子的杂化方式为_________。
(5)A、B、C三种元素可形成盐,则在形成的盐中存在的作用力有_____________。
(6)图甲是G单质的堆积方式,该堆积方式为__________堆积;GC2·H2O可通过CF4水解来制备,则该制备过程的化学方程式为_____________。
(7)A、D、E可形成化合物DEA4 ,在DEA4晶体中,与D+紧邻且等距的EA4-有_____个;DEA4晶体的密度为_____________g/cm3(用含a的代数式表示)。若DEA4晶胞上下底心处的D+被Li+取代,得到的晶体为__________(填化学式)。
【答案】 3d24s2 四面体形 O2和Na+的离子核外电子层结构完全相同,但Na+的质子数更多,对外层电子的吸引能力比O2更强,所以Na+半径更小 ![]() sp3杂化 共价键、离子键、配位键 ABABAB(或六方最密) TiCl4+3H2O=TiO2·H2O+4HCl 8
sp3杂化 共价键、离子键、配位键 ABABAB(或六方最密) TiCl4+3H2O=TiO2·H2O+4HCl 8 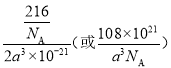 Na3Li(AlH4)4
Na3Li(AlH4)4
【解析】A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,A的某种原子无中子,A是H;B的最外层有3个成单电子,N是N;C与A可形成1:1和1:2的化合物且常温下呈液体,C是O;D的原子半径是短周期中最大的,D是Na;F的最高价氧化物对应水化物是最强的含氧酸,F是Cl;C和E形成的氧化物有两性,E是Al;G的最高能层符号为N,且其内层的d轨道电子数与最外层电子数相等,即原子序数是22,是Ti,则
(1)Ti原子的价电子排布式为3d24s2。(2)NH3分子中N原子价层电子对数是3+(5-3×1)/2=4,因此VSEPR模型为四面体形。(3)由于O2和Na+的离子核外电子层结构完全相同,但Na+的质子数更多,对外层电子的吸引能力比O2更强,所以Na+半径更小;(4)E与F形成的化合物EF3 在178℃时升华,其蒸气的相对分子质量约为267,这说明是氯化铝的二聚体,其中氯原子是配体,因此蒸气分子的结构式为![]() ,其中该蒸气分子中Al原子的价层电子对数是4,其杂化方式为sp3杂化。(5)A、B、C三种元素可形成盐,该盐是铵盐,其盐中存在的作用力有共价键、离子键、配位键。(6)根据Ti单质的堆积方式可知该堆积方式为ABABAB(或六方最密)堆积;TiO2·H2O可通过TiCl4水解来制备,则根据原子守恒可知该制备过程的化学方程式为TiCl4+3H2O=TiO2·H2O+4HCl。(7)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为4×54/NAg÷[(a×10-7 cm)2×2a×10-7 cm]=108×1021/NAa3gcm-3;若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li(AlH4)4。
,其中该蒸气分子中Al原子的价层电子对数是4,其杂化方式为sp3杂化。(5)A、B、C三种元素可形成盐,该盐是铵盐,其盐中存在的作用力有共价键、离子键、配位键。(6)根据Ti单质的堆积方式可知该堆积方式为ABABAB(或六方最密)堆积;TiO2·H2O可通过TiCl4水解来制备,则根据原子守恒可知该制备过程的化学方程式为TiCl4+3H2O=TiO2·H2O+4HCl。(7)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为4×54/NAg÷[(a×10-7 cm)2×2a×10-7 cm]=108×1021/NAa3gcm-3;若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li(AlH4)4。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案