题目内容
【题目】水溶液存在离子平衡,回答下列问题:
(1)Na2SO3水溶液呈________________(填“酸”、“中”、“碱”)性 ,原因是(用离子方程式):______________________________;
(2)已知T ℃时,纯水中c(OH)为10-6 mol·L-1,则
①该温度时0.1mol·L-1NaOH溶液pH为___________________。
②该温度下,将pH=2 的H2SO4溶液与pH=9的NaOH溶液按体积比1:9混合(忽略溶液体积变化),所得混合溶液的pH为________
③该温度下,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性(忽略溶液体积变化),则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___________。
(3)常温下,在25mL的氢氧化钠溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示。
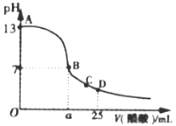
①在B点,溶液中n(CH3COO-)为______________________________。
②在D点,c(CH3COO) _________ c(Na+) (填“<”、“>”或“=”)。
③常温下将0.02mol CH3COONa和0.01mol盐酸溶于水,配成1L混合溶液。写出溶液中各离子浓度的大小关系为___________________________。
(4)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液pH为8时,c(Cu2+)=________。(已知常温时Cu(OH)2的Ksp=2.2×10-20)
【答案】碱 SO32-+H2O![]() HSO3- +OH- 11 4 a+b=11 0.0025mol >
HSO3- +OH- 11 4 a+b=11 0.0025mol > ![]() 2.2×10-8mol/L
2.2×10-8mol/L
【解析】
(2)已知T ℃时,纯水中c(OH)为10-6 mol·L-1,则c(H+)也为10-6 mol·L-1,则该温度下水的电离平衡常数Kw= c(OH)·c(H+)=10-12;
(3)常温下,未滴加醋酸溶液时氢氧化钠溶液的pH=13,则其浓度为0.1mol/L。
(1)Na2SO3水溶液中SO32-会水解,所以溶液显碱性,方程式为:SO32-+H2O![]() HSO3- +OH-;
HSO3- +OH-;
(2)①0.1 mol·L-1NaOH溶液中c(OH)=0.1 mol·L-1,该温度下水的电离平衡常数Kw=10-12,所以溶液中c(H+)=10-11mol/L,所以pH=11;
②pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=9的NaOH溶液c(OH)=10-3mol/L,设硫酸的体积为1L,则氢氧化钠溶液的体积为9L,可知酸过量,所以混合后溶液呈酸性,c(H+)=![]() ,所以溶液pH=4;
,所以溶液pH=4;
③pH1=a的某强酸溶液c(H+)=10-amol/L,pH2=b的某强碱溶液中c(OH)=10b-12mol/L,若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,所以10-amol/L×1=10b-12mol/L×10,解得a+b=11;
(3) 常温下,未滴加醋酸溶液时氢氧化钠溶液的pH=13,则其浓度为0.1mol/L。
①B点溶液中存在电荷守恒:c(OH)+ c(CH3COO-)=c(H+)+c(Na+),溶液呈中性,则c(OH)=c(H+),所以c(CH3COO-)=c(Na+),由于是在同一溶液中,所以n(CH3COO-)=n(Na+),据分析可知氢氧化钠溶液的浓度为0.1mol/L,所以25mL该溶液中n(Na+)=0.0025mol,所以B点n(CH3COO-)=0.0025mol;
②D点加入25mL0.2mol/L的醋酸溶液,则溶液中的溶质为等物质的量的CH3COONa和CH3COOH,电解质溶液呈酸性,c(H+)>c(OH),根据电荷守恒c(OH)+ c(CH3COO-)=c(H+)+c(Na+),所以c(CH3COO)>c(Na+);
③常温下将0.02mol CH3COONa和0.01mol盐酸溶于水,发生反应CH3COONa+HCl=CH3COOH+NaCl,配成1L混合溶液,则溶液中的溶质为等物质的量的CH3COONa、CH3COOH和NaCl,类似于曲线上的D点,溶液呈酸性,c(H+)>c(OH),醋酸电离呈酸性,醋酸根水解呈碱性,则c(CH3COO)>c(CH3COOH),根据物料守恒,c(CH3COO)+ c(CH3COOH)=2 c(Cl-),可得c(CH3COO)>c(Cl-),综合可得所以溶液中的例子浓度大小关系为:![]() ;
;
(4) Ksp[Cu(OH)2]= c2(OH)·c(Cu 2+)=2.2×10-20,pH=8则溶液中c(OH)=10-6mol/L,所以c(Cu 2+)=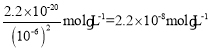 。
。