题目内容
【题目】在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________。
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为______________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为______________________________。
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为_________________。
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为___________________________。
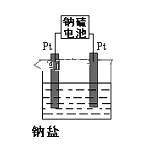
(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS![]() Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________。
【答案】A CH4-8e- +4CO32-=5CO2+2H2O MgCl2+2H2O ![]() Cl2↑+H2↑+Mg(OH)2↓ 0.8mol Cu+2H2O
Cl2↑+H2↑+Mg(OH)2↓ 0.8mol Cu+2H2O![]() Cu(OH)2+H2↑
Cu(OH)2+H2↑ ![]()
【解析】
(3)电解质中与电源负极相连的为阴极得电子发生还原反应,与电源正极相连的为阳极失电子发生氧化反应,即X为阴极,Y为阳极。
(1)首先要设计成原电池必须是氧化还原反应,则B不可行,能设计成原电池的反应通常是放热反应,即△H<0,所以A符合;
(2)所选反应为CH4(g)+O2(g)=CO2(g)+H2O(g) ,原电池中负极失电子发生氧化反应,所以负极反应物为甲烷,失电子被氧化,结合电解质为熔融KCO3,可得电极反应方程式为:CH4-8e- +4CO32-=5CO2+2H2O;
(3)①电解过程中,阳离子在阴极放电,MgCl2溶液中H+先于Mg2+反应,所以阳极氢离子得电子生成氢气,阴离子在阳极放电,Cl-先于OH-反应,失电子生成氯气,溶液中剩余的Mg2+和OH-结合生成Mg(OH)2,所以电解时总反应为:MgCl2+2H2O ![]() Cl2↑+H2↑+Mg(OH)2↓;
Cl2↑+H2↑+Mg(OH)2↓;
②电解CuSO4溶液时阴极先是铜离子反应,当Cu2+反应完后H+反应,但阳极一直是OH-放电生成O2,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,说明电解过程中阳极产生的氧气为0.2mol,生成1个氧气分子转移4个电子,所以生成0.2mol O2转移的电子的物质的量为0.8mol;
③若Y为铜,即电解池的阳极为铜,此时阳极反应为:Cu-2e-+2H2O= Cu(OH)2+2 H+,阴极为H+反应,电极方程式为:2H++2e-=H2,所以总反应为:Cu+2H2O![]() Cu(OH)2+H2↑;
Cu(OH)2+H2↑;
(4)由原电池原理可知放电时,S得电子发生还原反应,所以S作正极,正极反应为xS+2e-=Sx2-。

【题目】下列设计的实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体其水溶液呈中性,观察溶液颜色变化 |
D | 证明溴乙烷的消去反应有乙烯生成 | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性KMnO4溶液中 |
A.AB.BC.CD.D