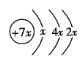题目内容
【题目】某溶液中可能含有 Na+、K+、NH4+、Cu2+、SO42-、SO32-、MnO4-、Cl-、Br-、CO32-等离子,且所含离子的物质的量的浓度都相等。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成了如下实验:
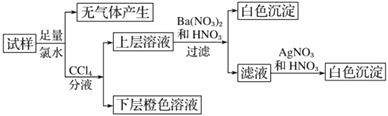
则关于原溶液组成的判断中正确的是:
A.肯定不存在的离子是 Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+另需实验验证;
B.肯定存在的离子是SO32-、Br-,且Na+、K+至少有一种存在;
C.无法确定原溶液中是否存在Cl-;
D.若步骤中Ba(NO3)2和HNO3溶液改用 BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响。
【答案】D
【解析】
往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则原溶液中无![]() ,加足量氯水,无气体,则无
,加足量氯水,无气体,则无![]() ,溶液加四氯化碳分液,下层橙色,则有Br-,上层加硝酸钡和稀硝酸有白色沉淀,有
,溶液加四氯化碳分液,下层橙色,则有Br-,上层加硝酸钡和稀硝酸有白色沉淀,有![]() ,因
,因![]() 与Cu2+能够发生相互促进的双水解反应,则原溶液中无Cu2+,因Br-、
与Cu2+能够发生相互促进的双水解反应,则原溶液中无Cu2+,因Br-、![]() 与
与![]() 能够发生氧化还原反应,因此原溶液中无
能够发生氧化还原反应,因此原溶液中无![]() ,溶液中一定含阳离子,且离子浓度都相等,根据电荷守恒,一定含有
,溶液中一定含阳离子,且离子浓度都相等,根据电荷守恒,一定含有![]() 、Na+、K+,一定不存在Cl-,滤液中加硝酸酸化的硝酸银有白色沉淀,是过程中加氯水时引入的氯离子。
、Na+、K+,一定不存在Cl-,滤液中加硝酸酸化的硝酸银有白色沉淀,是过程中加氯水时引入的氯离子。
A.分析可知肯定不存在的离子是Cu2+、![]() 、
、![]() 、Cl-、
、Cl-、![]() ,一定含
,一定含![]() ,故A错误;
,故A错误;
B.肯定存在的离子为:![]() 、
、![]() 、Br,根据溶液电中性可知原溶液中一定含有Na+、K+,故B错误;
、Br,根据溶液电中性可知原溶液中一定含有Na+、K+,故B错误;
C.根据电荷守恒,一定不存在Cl,故C错误;
D.加入Ba(NO3)2和HNO3溶液目的是检验硫酸根离子,因之前加入了氯水,氯水具有强氧化性,因此![]() 不会对检验硫酸根离子存在干扰,若改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,故D正确;
不会对检验硫酸根离子存在干扰,若改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,故D正确;
故答案为:D。