题目内容
【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示,下列关系不正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
A.酸性:H2CO3>![]()
B.水电离产生的c(H+):①=②
C.溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1molL﹣1
D.溶液④中:c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
【答案】B
【解析】
①NaCl为强酸强碱盐,pH为7;②CH3COONH4的pH也为7,为弱酸弱碱盐,说明![]() 和
和![]() 的水解程度相等;③、④都为强碱弱酸盐,pH越大,说明水解程度越大,则对应的酸越弱,结合物料守恒解答该题。
的水解程度相等;③、④都为强碱弱酸盐,pH越大,说明水解程度越大,则对应的酸越弱,结合物料守恒解答该题。
A.③、④都为强碱弱酸盐,pH越大,说明水解程度越大,则对应的酸越弱,可以知道酸性:![]()
![]() ,所以A正确;
,所以A正确;
B. NaCl属于强酸强碱盐,对水的电离平衡没有影响,CH3COONH4为弱酸弱碱盐,水解促进水的电离,水电离产生的c(H+):① 小于 ②,故B错误;
C.0. 1mol/L的![]() 中存在的物料守恒为
中存在的物料守恒为![]()
![]()
,所以C正确;
D. ![]() 水解呈碱性,溶液存在c(Na+)>c(
水解呈碱性,溶液存在c(Na+)>c(![]() )>c(OH-)> c(H+),所以D正确;
)>c(OH-)> c(H+),所以D正确;
所以答案选B。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
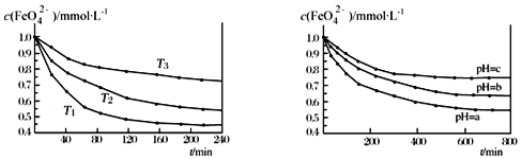
芒果教辅达标测试卷系列答案【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。
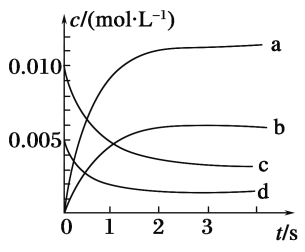
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
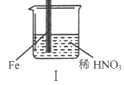
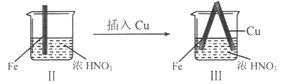
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化