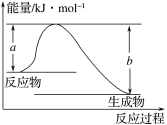
题目内容
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质 (以C 计)与水蒸气反应制取H2是种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
II CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
III CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
IV C(s)+O2(g)=CO2
V CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
A.容器内压强不再变化 B. H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成a molH-H键的同时断裂2amolH-O键
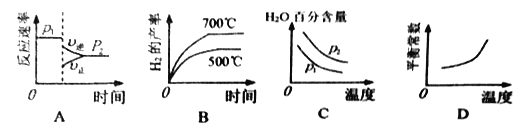
(2)对于反应I,不同温度和压强对H2产率影响如下表。
温度 | 压强p1/Mpa | 压强p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是__________________。
(3)已知反应Ⅱ的ΔH=-41.1kJ/mol,C=O、O-H、H-H的键能分别为 803 kJ/mol,464 kJ/mol、436 kJ/mol,则CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为___________;当重新平衡后,CO2浓度___________(填“变大”“ 变小”“ 不变”)。
(5)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:
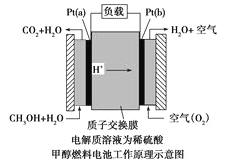
请回答下列问题:
①Pt(a)电极是电池的_______极,电极反应式为______________________;
②常温下,用此电池以惰性电极电解0.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH=_________(忽略溶液的体积变化)。
【答案】 K1·K2·K3 BC BD 1072.9 正向移动或向右移动 不变 负 CH3OH-6e-+H2O=CO2+6H+ 13
【解析】(1)已知:① C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
② CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
③ CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
根据盖斯定律可知①+②+③即得到制H2总反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),所以该反应的平衡常数K=K1·K2·K3。A.反应前后体积不变,容器内压强不再变化不能说明反应达到平衡状态,A错误;B. 由于只有两种气体,因此H2与H2O(g)的物质的量之比不再变化说明正逆反应速率相等,达到平衡状态,B正确;C.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此混合气体的密度不再变化说明达到平衡状态,C正确;D.形成a molH-H键的同时断裂2amolH-O键均表示正反应速率,不能说明反应达到平衡状态,D错误,答案选BC;(2)压强相同时升高温度氢气的产率增加,说明正反应是吸热反应;温度相同时,增大压强平衡向逆反应方向进行,氢气产率降低,所以压强是P1>P2,则A、降低压强时平衡向正反应方向进行,正反应速率大于逆反应速率,A错误;B、升高温度平衡向正反应方向进行,氢气产率增大,B正确;C、温度相同时增大压强平衡向逆反应方向进行,水蒸气含量增大,C错误;D、升高温度平衡向正反应方向进行,平衡常数增大,D正确,答案选BD;(3)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,已知反应Ⅱ的ΔH=-41.1kJ/mol,则x+2×464-2×803-436=-41.1,解得x=1072.9,即CO中碳氧键的键能为1072.9kJ/mol。(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向正反应方向移动;由于该反应的平衡常数K=c(CO2),温度不变,平衡常数不变,所以当重新平衡后,CO2浓度不变。(5)①Pt(a)电极充入甲醇,产生CO2,所以是电池的负极,由于存在质子交换膜,则负极电极反应式为 CH3OH-6e-+H2O=CO2+6H+;②惰性电极电解饱和食盐水两电极分别产生氢气和氯气,且二者的物质的量相等,均是0.56L÷22.4L/mol=0.025mol,所以生成氢氧化钠是0.05mol,氢氧根的浓度是0.05mol÷0.5L=0.1mol/L,则电解后溶液的pH=13。
CaCO3(s)+2H2(g),所以该反应的平衡常数K=K1·K2·K3。A.反应前后体积不变,容器内压强不再变化不能说明反应达到平衡状态,A错误;B. 由于只有两种气体,因此H2与H2O(g)的物质的量之比不再变化说明正逆反应速率相等,达到平衡状态,B正确;C.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此混合气体的密度不再变化说明达到平衡状态,C正确;D.形成a molH-H键的同时断裂2amolH-O键均表示正反应速率,不能说明反应达到平衡状态,D错误,答案选BC;(2)压强相同时升高温度氢气的产率增加,说明正反应是吸热反应;温度相同时,增大压强平衡向逆反应方向进行,氢气产率降低,所以压强是P1>P2,则A、降低压强时平衡向正反应方向进行,正反应速率大于逆反应速率,A错误;B、升高温度平衡向正反应方向进行,氢气产率增大,B正确;C、温度相同时增大压强平衡向逆反应方向进行,水蒸气含量增大,C错误;D、升高温度平衡向正反应方向进行,平衡常数增大,D正确,答案选BD;(3)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,已知反应Ⅱ的ΔH=-41.1kJ/mol,则x+2×464-2×803-436=-41.1,解得x=1072.9,即CO中碳氧键的键能为1072.9kJ/mol。(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向正反应方向移动;由于该反应的平衡常数K=c(CO2),温度不变,平衡常数不变,所以当重新平衡后,CO2浓度不变。(5)①Pt(a)电极充入甲醇,产生CO2,所以是电池的负极,由于存在质子交换膜,则负极电极反应式为 CH3OH-6e-+H2O=CO2+6H+;②惰性电极电解饱和食盐水两电极分别产生氢气和氯气,且二者的物质的量相等,均是0.56L÷22.4L/mol=0.025mol,所以生成氢氧化钠是0.05mol,氢氧根的浓度是0.05mol÷0.5L=0.1mol/L,则电解后溶液的pH=13。

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ·mol-1)依次为 578、1817、2745、11575、14830、18376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)X元素位于元素周期表第____周期____族; R是________区的元素。
(2)请写出Q元素基态原子的外围电子排布图____。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是________。(用元素符号表示)
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是________。
(5)含Z元素的焰火显黄色,主要与________有关。
(6)M元素原子的逐级电离能越来越大的原因是________。
(7)与M元素成“对角线规则”关系的某短周期元素T的最髙价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:________;己知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是________。(填“离子化合物”或“共价化合物”)