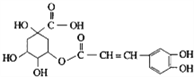
题目内容
【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ·mol-1)依次为 578、1817、2745、11575、14830、18376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)X元素位于元素周期表第____周期____族; R是________区的元素。
(2)请写出Q元素基态原子的外围电子排布图____。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是________。(用元素符号表示)
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是________。
(5)含Z元素的焰火显黄色,主要与________有关。
(6)M元素原子的逐级电离能越来越大的原因是________。
(7)与M元素成“对角线规则”关系的某短周期元素T的最髙价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:________;己知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是________。(填“离子化合物”或“共价化合物”)
【答案】 2周期 IVA族 d  O<C<Al<Na 因为Fe3+的价层电子排布为3d5,处于d能级半充满状态,能量低,结构稳定 电子跃迁 因为随着电子逐个失去,阳离子所带正电荷数越来越多,再失去2个电子需要克服的电性吸引越来越大,消耗能量越来越多 Be(OH)2+2NaOH=Na2BeO2+2H2O 共价化合物
O<C<Al<Na 因为Fe3+的价层电子排布为3d5,处于d能级半充满状态,能量低,结构稳定 电子跃迁 因为随着电子逐个失去,阳离子所带正电荷数越来越多,再失去2个电子需要克服的电性吸引越来越大,消耗能量越来越多 Be(OH)2+2NaOH=Na2BeO2+2H2O 共价化合物
【解析】X、Y、Z、M、Q、R均为前四周期元素,且原子序数依次增大:X元素原子核外有6种不同运动状态的电子,则X为碳元素;Y元素的基态原子中s电子总数与p电子总数相等,则核外电子排布为1s22s22p4,则Y为氧元素;Z元素的原子半径在同周期元素中最大且应该在第三周期,则Z为钠元素;M原子的第四电离能剧增,表现+3价,则M为Al元素;Q元素的基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反,则p轨道上有5个电子,则Q为氯元素;元素R基态原子核外有7个能级且能量最高的能级上有6个电子,则核外电子排布为1s22s22p63s23p63d64s2,则 R为铁元素。⑴X元素是碳元素,位于元素周期表第二周期IVA族; R为铁元素,是d区的元素;(2) Q是氯元素,基态原子的外围电子排布图为: ;⑶X、Y、Z、M四种元素的原子半径由小到大的顺序是O<C<Al<Na;(4)铁元素可形成Fe2+和Fe3+,其中较稳定的是Fe3+,因为Fe3+的价层电子排布为3d5,处于d能级半充满状态,能量低,结构稳定;(5)含钠元素的焰火显黄色,主要与电子跃迁有关;(6) 铝元素原子的逐级电离能越来越大的是因为随着电子逐个失去,阳离子所带正电荷数越来越多,再失去2个电子需要克服的电性吸引越来越大,消耗能量越来越多;(7)与铝元素成“对角线规则”关系的某短周期元素铍的最髙价氧化物的水化物具有两性,该两性物质与钠元素的最高价氧化物的水化物氢氧化钠反应的化学方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O;己知铍元素和氯元素的电负性分别为1.5和3.0,3.0-1.5=1.5<1.7,电负性差值小于1.7,则它们形成的化合物是共价化合物。
;⑶X、Y、Z、M四种元素的原子半径由小到大的顺序是O<C<Al<Na;(4)铁元素可形成Fe2+和Fe3+,其中较稳定的是Fe3+,因为Fe3+的价层电子排布为3d5,处于d能级半充满状态,能量低,结构稳定;(5)含钠元素的焰火显黄色,主要与电子跃迁有关;(6) 铝元素原子的逐级电离能越来越大的是因为随着电子逐个失去,阳离子所带正电荷数越来越多,再失去2个电子需要克服的电性吸引越来越大,消耗能量越来越多;(7)与铝元素成“对角线规则”关系的某短周期元素铍的最髙价氧化物的水化物具有两性,该两性物质与钠元素的最高价氧化物的水化物氢氧化钠反应的化学方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O;己知铍元素和氯元素的电负性分别为1.5和3.0,3.0-1.5=1.5<1.7,电负性差值小于1.7,则它们形成的化合物是共价化合物。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质 (以C 计)与水蒸气反应制取H2是种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
II CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
III CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
IV C(s)+O2(g)=CO2
V CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
A.容器内压强不再变化 B. H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成a molH-H键的同时断裂2amolH-O键
(2)对于反应I,不同温度和压强对H2产率影响如下表。
温度 | 压强p1/Mpa | 压强p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是__________________。

(3)已知反应Ⅱ的ΔH=-41.1kJ/mol,C=O、O-H、H-H的键能分别为 803 kJ/mol,464 kJ/mol、436 kJ/mol,则CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为___________;当重新平衡后,CO2浓度___________(填“变大”“ 变小”“ 不变”)。
(5)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:

请回答下列问题:
①Pt(a)电极是电池的_______极,电极反应式为______________________;
②常温下,用此电池以惰性电极电解0.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH=_________(忽略溶液的体积变化)。