题目内容
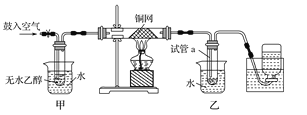
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):
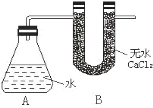
①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B反应前总质量为 m g,反应后 A、B 的总质量为 n g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠浮在水面,产生这一现象原因是:_____________
(2)用 a、m、n 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:
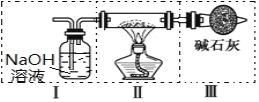
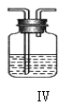
(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. II 和 III 之间 C.I 和 II 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为______________。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有1.56 g Na2O2、3.36g NaHCO3的固体混合物放在密闭容器中加热,最后固体是___________(填化学式),质量为_________g.
【答案】钠的密度比水的密度小 23(a+m-n)/a 偏大 浓硫酸 C 钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体 能 Na2CO3 4.24
【解析】
Ⅰ、(1)根据钠浮在水面上反应分析解答;
(2)生成氢气的质量=样品质量+反应前A与B总质量-反应后A与B总质量,结合Na与水反应的化学方程式计算样品中钠的质量,再计算样品中钠的质量分数;
(3)装置B中CaCl2可吸收氢气中混有的水蒸气,否则测定生成氢气的质量偏大;
Ⅱ、用金属钠和空气制备纯度较高的Na2O2,由实验装置可知,I中NaOH溶液可除去空气中的二氧化碳,将装置Ⅳ接在I与II之间,可除去水蒸气,II中Na与氧气反应生成过氧化钠,III中碱石灰可防止空气中的水蒸气和二氧化碳进入Ⅱ中,且实验时先通入空气后点燃酒精灯,防止Na与二氧化碳、水蒸气反应,以此来解答;
Ⅲ、根据2NaHCO3![]() Na2CO3+H2O +CO2、2Na2O2 + 2H2O = 4NaOH + O2 ↑、2Na2O2 +2CO2 = 2Na2CO3 + O2分析解答。
Na2CO3+H2O +CO2、2Na2O2 + 2H2O = 4NaOH + O2 ↑、2Na2O2 +2CO2 = 2Na2CO3 + O2分析解答。
Ⅰ、(1)钠的密度比水的密度小,因此钠浮在水面上反应,故答案为:钠的密度比水的密度小;
(2)反应中生成的氢气质量为(a+m-n)g,设样品中钠的质量为wg,则:
2Na+2H2O=2NaOH+H2↑
46 2
wg (a+m-n)g
![]() =
=![]() ,解得:w=23(a+m-n),样品中钠的质量分数为:
,解得:w=23(a+m-n),样品中钠的质量分数为:![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
(3)装置B是干燥氢气的,如果没有B装置,会导致生成氢气的质量偏大,使得钠的质量分数偏大,故答案为:偏大。
Ⅱ、(4)空气中含有少量二氧化碳和水蒸气,二氧化碳通过氢氧化钠被吸收,因此装置Ⅳ中盛放的试剂是浓硫酸,是吸收水蒸气,为完成实验应将装置Ⅳ接在I和II之间,干燥空气,故答案为:浓硫酸;C;
(5)点燃酒精灯后,观察到装置 II 中的现象为钠先熔化成光亮的小球,然后剧烈燃烧产生黄色火焰,生成淡黄色固体,故答案为:钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体;
Ⅲ、(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,2Na2O2 +2CO2 == 2Na2CO3 + O2,且该反应为放热反应,因此脱脂棉燃烧起来,故答案为:能;
(7)1.56 g Na2O2的物质的量为![]() =0.02mol,3.36g NaHCO3的物质的量为
=0.02mol,3.36g NaHCO3的物质的量为![]() =0.04mol,根据2NaHCO3
=0.04mol,根据2NaHCO3![]() Na2CO3+H2O +CO2,完全分解后生成0.02mol H2O,0.02mol CO2和0.02mol Na2CO3;根据2Na2O2 + 2H2O = 4NaOH + O2 ↑,2Na2O2 +2CO2 = 2Na2CO3 + O2反应可知,由于氢氧化钠也能与二氧化碳反应,因此首先考虑2Na2O2 +2CO2 = 2Na2CO3 + O2,0.02mol Na2O2和0.02mol CO2恰好反应生成0.02mol Na2CO3,因此最后得到的固体为碳酸钠,物质的量为0.02mol +0.02mol=0.04mol,质量为0.04mol×106g/mol=4.24g,故答案为:Na2CO3;4.24。
Na2CO3+H2O +CO2,完全分解后生成0.02mol H2O,0.02mol CO2和0.02mol Na2CO3;根据2Na2O2 + 2H2O = 4NaOH + O2 ↑,2Na2O2 +2CO2 = 2Na2CO3 + O2反应可知,由于氢氧化钠也能与二氧化碳反应,因此首先考虑2Na2O2 +2CO2 = 2Na2CO3 + O2,0.02mol Na2O2和0.02mol CO2恰好反应生成0.02mol Na2CO3,因此最后得到的固体为碳酸钠,物质的量为0.02mol +0.02mol=0.04mol,质量为0.04mol×106g/mol=4.24g,故答案为:Na2CO3;4.24。

【题目】实验室需配制80mL0.1mol/L的碳酸钠溶液,填空并回答下列问题:
(1)配制80mL1.0mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
___ | ___ |
(2)配制时,其正确的操作顺序为___(用字母表示,每个字母只能用一次)。
A.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
B.将容量瓶盖紧,上下颠倒,摇匀
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
F.改为胶头滴管加水,使溶液凹液面恰好与刻度线相切
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若定容时仰视刻度线,结果会___;
若容量瓶中有少量蒸馏水,结果会___。
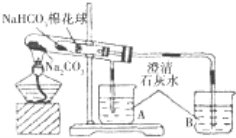
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。