题目内容
3.(CH3CH2)2CHCH3的正确命名是( )| A. | 2-乙基丁烷 | B. | 2-甲基戊烷 | C. | 3-甲基戊烷 | D. | 3-乙基丁烷 |
分析 烷烃命名时,碳原子的编号从离支链最近的碳原子开始;相同的取代基要合并;取代基的位次和最小;乙基不能出现在2号碳原子上;根据烷烃的命名规则来分析.
解答 解:A、乙基不能出现在2号碳原子上,故A错误;
B、选取含碳原子最多的为主链,甲基在三号碳原子上,2-甲基戊烷的结构简式为CH3CH(CH3)CH2CH2CH3,不符合所给结构简式,故B错误;
C、根据烷烃的命名规则,3-甲基戊烷符合命名原则,故C正确;
D、3-乙基丁烷的主碳链不是最长,编号应从离取代基近的一端编号,故D错误;
故选C.
点评 本题考查烷烃的命名方法,可以根据烷烃的命名原则进行分析回答,较简单.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
13.下列叙述中正确的是( )
| A. | 金属的熔点和沸点都很高 | |
| B. | H2O、CCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
14.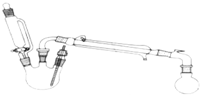 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
合成反应:在三颈烧瓶中加入乙醇5mL,硫酸5mL,2小片碎瓷片.漏斗加入乙酸14.3mL,乙醇20mL.冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120℃.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾.最终通过蒸馏得到纯净的乙酸乙酯. 回答下列问题:
(1)制取乙酸乙酯化学方程式为:CH3COOH+CH3CH2OH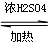 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
(2)浓硫酸与乙醇如何混合?先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(5)蒸出的粗乙酸乙酯中主要有哪些杂质?乙醚、乙酸、乙醇和水.
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示)不能;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
 某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)
某研究性小组探究乙酸乙酯的反应机理,实验如下:已知:相关物理性质(常温常压)| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
(1)制取乙酸乙酯化学方程式为:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.(2)浓硫酸与乙醇如何混合?先向三颈烧瓶加入乙醇,再沿着瓶壁缓慢加入浓硫酸,边振荡边滴加.
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是?保证乙醇量是乙酸量10倍以上,提高乙酸的转化率.
(5)蒸出的粗乙酸乙酯中主要有哪些杂质?乙醚、乙酸、乙醇和水.
(6)饱和的Na2CO3溶液洗涤除去乙酸,能否换成NaOH溶液?若不能,为什么?(用化学方程式表示)不能;CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH.用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水?减少乙酸乙酯溶解.
11.下列有关甲苯的实验事实中,能说明侧链对苯环性质有影响的是( )
| A. | 甲苯与硝酸发生取代反应生成三硝基甲苯 | |
| B. | 甲苯能使热的KMnO4酸性溶液褪色 | |
| C. | 甲苯燃烧时产生带浓烈黑烟的火焰 | |
| D. | 1 mol甲苯最多能与3 mol氢气发生加成反应 |
18.正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | H、D、T互为同素异形体 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | NH4Cl的电子式: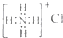 | |
| D. | S2-的结构示意图: |
8.如图为香芹酮分子的结构,下列有关叙述正确的是( )
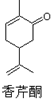

| A. | 香芹酮化学式为C10H14O | |
| B. | 香芹酮可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮分子中有3种官能团 |
15.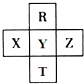 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )| A. | 非金属性:Z<Y<X | |
| B. | R与Y的电子数相差8 | |
| C. | 气态氢化物稳定性:HR<HY<HT | |
| D. | 最高价氧化物的水化物的酸性:HTO4>HYO4 |
13.研究NO2、SO2、CO等大气污染气体测量及处理具有重要意义,目前,消除污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
①T1℃时,该反应的平衡常数K=0.56(保留两位小数).
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.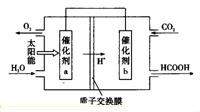 3×10-8mol•L-1)
3×10-8mol•L-1)
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2N0(g)?N2(g)+C02(g)△H.某研究小组 向某密闭容器中加人一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下.
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度;
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”)..
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+CO2(g)+2H20(g)△H=-574 kJ•mol-1
②CH4(g)+4N0(g)═2N2(g)+C02(g)+2H20(g)△H=-1160 kJ•mol-1
③H2O(g)═H20(l)△H=-44.0 kJ.mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g)、CO2 (g)和H20(1)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(3)新型氨法烟气脱硫技术化学原理是采用氨水吸收烟气中的SO2,再用一定量磷酸与上述吸收产物反应.该技术优点除了能回收利用S02外,还能得到一种复合肥料.
①该复合肥料可能的化学式为(NH4)3PO4、(NH4)2HPO4、NH4H2PO4(写出一种即可).
②若氨水与SO2恰好完全反应生成正盐,则此时溶液呈碱性(填“酸”或“碱”).
(已知常温下:氨水 Kb=1.8×10-5 mol•L-1,H2SO4 Ka1=1.3×10-2 mol•L-1,Ka2=6.
 3×10-8mol•L-1)
3×10-8mol•L-1)(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.如图是通过人工光合作用,以CO2和H20为原料制备HCOOH和02的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下,0.1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka=10-7.
14.为了除去CO2中含有少量的SO2气体,可以使气体通过( )
| A. | Na2CO3溶液 | B. | H2SO4溶液 | C. | NaHCO3溶液 | D. | Ba(OH)2溶液 |