题目内容
【题目】已知A、B、C、D、E、W是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同。W是第四周期d区原子序数最大的元素。请回答下列问题:
(1)填元素名称, C:________写出E的价层电子排布式_________,W在周期表中的位置:___________________
第二周期基态原子未成对电子数与W相同且电负性最小的元素是________(填元素符号).
(2)W(BD)n为无色挥发性剧毒液体,熔点﹣25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,W(BD)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,BD分子的结构式是________
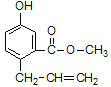
(3)3﹣氯﹣2﹣丁氨酸的结构简式为:![]() ,一个该有机物分子中含有_____个手性碳原子.
,一个该有机物分子中含有_____个手性碳原子.
【答案】氮 3d24s2 第四周期第VIII族 C 4 C≡O 2
【解析】
A、B、C、D、W都是元素周期表中前36号的元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,A是H元素;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,B的核外电子排布式是1s22s22p2,B是C元素;D的基态原子核外成对电子数是成单电子数的3倍,D是O元素;则C是N元素;E4+与氩原子的核外电子排布相同,E是22号Ti元素;W是第四周期d区原子序数最大的元素,W是Ni元素。
(1)C是氮元素,E是是22号Ti元素,价层电子排布式3d24s2,W是Ni元素在周期表中的位置是第四周期第VIII族;Ni有2个未成对电子,第二周期基态原子未成对电子数是2的元素是C、O,非金属性越弱电负性越小,电负性最小的元素是C元素。
(2)Ni(CO)n中Ni价电子数是10,每个配位原子提供1对电子,中心原子价电子数与配体提供电子总数之和为18,则n=4,CO分子与氮气互为等电子体,结构式是C≡O;
(3)手性碳原子是连有4个不同原子或原子团的碳原子, ![]() ,含有2个手性碳原子。
,含有2个手性碳原子。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生氢气体积(V)的数据,根据数据绘制如图,则曲线a、b、c、d所对应的实验组别可能是( )

组别 | c(HCl)/(molL-1) | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.④—③—②—①B.①—②—③—④
C.③—④—②—①D.①—②—④—③