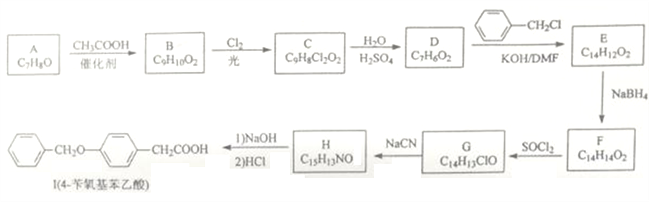
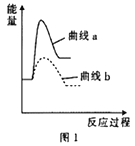
题目内容
【题目】氯及其化合物在工农业生产和日常生活中有着广泛的用途。
Ⅰ.实验室用下图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃~5℃、强碱性溶液中比较稳定。
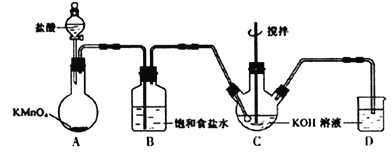
(1)装置A中的玻璃仪器的名称分别是___________。
(2)装置A中KMnO4与盐酸反应生成KCl、MnCl2和Cl2,其离子方程式为_______________________。将制备的Cl2通过装置B可除去___________ (填化学式)。
(3)Cl2和KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________________。
Ⅱ.某学习小组用下图装置制取并收集ClO2。(已知无水草酸在100℃可以升华)
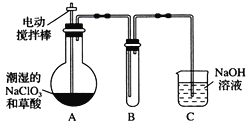
(1)实验时装置A需在60℃~100℃进行的原因是_________________________。
(2)电动搅拌棒的作用是_______________________。
(3)装置A中反应产物有Na2CO3、ClO2和CO2等,用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根高子(ClO2-)。
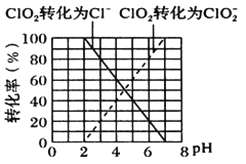
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示
②当pH≤2.0时,写出ClO2被I-还原的离子方程式________________________________。
③当pH为7.0~8.0时,ClO2的还原产物为___________。
【答案】 分液漏斗、圆底烧瓶 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O HCl 缓慢滴加盐酸、装置C加冰水浴等 温度过低,化学反应速率较慢,温度过高草酸升华或分解 将反应物充分混合(或充分反应、或使反应物混合均匀) 2ClO2+10I-+8H+=2Cl-+5I2+4H2O ClO2-
【解析】Ⅰ.(1)装置A中的玻璃仪器的名称分别是分液漏斗、圆底烧瓶;(2)装置A中KMnO4与盐酸反应生成KCl、MnCl2和Cl2,其离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;装置B中装饱和食盐水,将制备的Cl2通过装置B可除去HCl;(2)控制反应温度0 ℃~5 ℃,可以采用冰水浴冷却C装置。因为Cl2和KOH是放热反应,若氯气通入速率过快,与KOH溶液反应速率快,放出热量多,反应温度高,易生成KClO3,所以可以通过缓慢滴加盐酸来控制生成氯气的速率,进而控制反应温度;Ⅱ.(1)一般来说,升高温度,活化分子的百分数增大,反应速率增大,温度过低,化学反应速率较慢,无水草酸100℃可以升华,温度过高草酸升华或分解,所以实验时装置A需在60℃~100℃进行;(2) 电动搅拌棒的作用是将反应物充分混合(或充分反应、或使反应物混合均匀);(3)②当pH≤2.0时,由图中曲线可知,ClO2被I-还原为Cl-,反应的离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O;③当pH为7.0~8.0时,ClO2-浓度较高,ClO2的还原产物为ClO2-。

【题目】Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列问题:
(1)CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
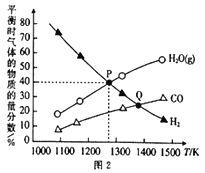
(3)在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。

该反应为___________反应(填“吸热”或“放热”),已知图中a点对应温度下,NO2的起始压强P0为120kPa,计算该温度下反应的平衡常数Kp的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
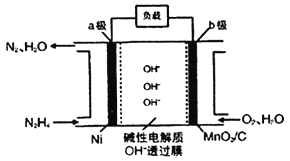
N2H4的电子式为___________;a极的电极反应方程式为___________;