题目内容
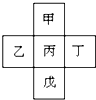
如图所示是前四周期的五种元素在周期表中的相对位置关系.乙和丁的原子序数之和为甲的4倍,则
(1)用电子式表示丁的气态氢化物的形成过程为:______;
(2)乙、丁按原子个数比1:3组成的化合物电子式为(各原子最外层均达到8e-稳定结构)______;
(3)丙的气态氢化物的结构式为______;
(4)戊的原子序数为______;在元素周期表中的位置为第______周期______族;
(5)原子半径大小关系为:丁______戊;(简单)离子半径大小关系为:丙______丁;
(6)乙、丙、丁的最高价氧化物水化物中,不属于强酸的是______(填化学式);
(7)甲和丙形成的某化合物A可以使下列溶液褪色:①溴水②品红溶液③高锰酸钾酸性溶液④滴有酚酞的氢氧化钠溶液,其中A表现漂白性的是______(填序号).
(1)用电子式表示丁的气态氢化物的形成过程为:______;
(2)乙、丁按原子个数比1:3组成的化合物电子式为(各原子最外层均达到8e-稳定结构)______;
(3)丙的气态氢化物的结构式为______;
(4)戊的原子序数为______;在元素周期表中的位置为第______周期______族;
(5)原子半径大小关系为:丁______戊;(简单)离子半径大小关系为:丙______丁;
(6)乙、丙、丁的最高价氧化物水化物中,不属于强酸的是______(填化学式);
(7)甲和丙形成的某化合物A可以使下列溶液褪色:①溴水②品红溶液③高锰酸钾酸性溶液④滴有酚酞的氢氧化钠溶液,其中A表现漂白性的是______(填序号).

前四周期的五种元素,由甲、丙、戊的位置可知,不是处于第一列与最后一列,故甲、丙、戊分别为二、三、四周期,结合乙、丙、丁相邻可知,应处于过渡元素之后.令甲的原子顺序为x,则乙的原子序数为x+8-1=x+7,丁的原子序数为x+8+1=x+9,乙和丁的原子序数之和为甲的4倍,则x+7+x+9=4x,解得x=8,故甲为O、乙为P、丙为S、丁为Cl、戊为Se,
(1)丁的气态氢化物为HCl,用电子式表示形成过程为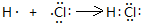 ,
,
故答案为: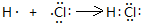 ;
;
(2)乙、丁按原子个数比1:3组成的化合物为PCl3,各原子最外层均达到8e-稳定结构,其电子式为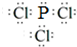 ,故答案为:
,故答案为: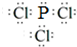 ;
;
(3)丙的气态氢化物为H2S,结构式为H-S-H,故答案为:H-S-H;
(4)戊为Se,原子序数为16+18=34,在元素周期表中的位置为第四周期ⅥA族,故答案为:34;四、ⅥA;
(5)同主族自上而下原子半径增大,同周期自左而右原子半径减小,故原子半径:丁<戊;丙、丁简单离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:丙>丁,故答案为:<;>;
(6)乙、丙、丁的最高价氧化物水化物中,硫酸、高氯酸为强酸,磷酸为中强酸,不属于强酸的是H3PO4,故答案为:H3PO4;
(7)甲和丙形成的某化合物A为SO2,与溴水、高锰酸钾酸性发生氧化还原反应,使它们颜色褪去,二氧化硫表现还原性,使品红溶液褪色表现漂白性,与滴有酚酞的氢氧化钠溶液反应,使其褪色,表现二氧化硫是酸性氧化物性质,
故答案为:②.
(1)丁的气态氢化物为HCl,用电子式表示形成过程为
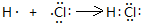 ,
,故答案为:
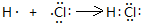 ;
;(2)乙、丁按原子个数比1:3组成的化合物为PCl3,各原子最外层均达到8e-稳定结构,其电子式为
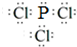 ,故答案为:
,故答案为: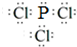 ;
;(3)丙的气态氢化物为H2S,结构式为H-S-H,故答案为:H-S-H;
(4)戊为Se,原子序数为16+18=34,在元素周期表中的位置为第四周期ⅥA族,故答案为:34;四、ⅥA;
(5)同主族自上而下原子半径增大,同周期自左而右原子半径减小,故原子半径:丁<戊;丙、丁简单离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:丙>丁,故答案为:<;>;
(6)乙、丙、丁的最高价氧化物水化物中,硫酸、高氯酸为强酸,磷酸为中强酸,不属于强酸的是H3PO4,故答案为:H3PO4;
(7)甲和丙形成的某化合物A为SO2,与溴水、高锰酸钾酸性发生氧化还原反应,使它们颜色褪去,二氧化硫表现还原性,使品红溶液褪色表现漂白性,与滴有酚酞的氢氧化钠溶液反应,使其褪色,表现二氧化硫是酸性氧化物性质,
故答案为:②.

练习册系列答案
相关题目