题目内容
有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
①X与Z、Y与W分别同主族;
②X、Z、W分别与Y都能形成两种常见的化合物;
③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
(1)写出由Y与Z形成的化合物Z2Y2的电子式:______,WY2与X2Y2反应生成粘稠油状液体的化学方程式:______
(2)用离子方程式表示只含X、Z、W三种元素的化合物的水溶液呈碱性的原因:______
(3)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为:______
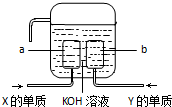
(4)X、Y两种元素的单质已经被应用于飞船的燃料电池中,如图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电.①a是装置的______极.②b极上的电极反应式是______.
①X与Z、Y与W分别同主族;
②X、Z、W分别与Y都能形成两种常见的化合物;
③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
(1)写出由Y与Z形成的化合物Z2Y2的电子式:______,WY2与X2Y2反应生成粘稠油状液体的化学方程式:______
(2)用离子方程式表示只含X、Z、W三种元素的化合物的水溶液呈碱性的原因:______
(3)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为:______
(4)X、Y两种元素的单质已经被应用于飞船的燃料电池中,如图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电.①a是装置的______极.②b极上的电极反应式是______.

有原子序数依次增大的4种短周期元素X、Y、Z、W,①X与Z、Y与W分别同主族,③Y的阴离子与Z的阳离子核外电子排布相同,则Y是第二周期元素,Z和W是第三周期元素,且Z是金属元素,②X、Z、W分别与Y都能形成两种常见的化合物,形成的化合物中都含有变价元素,第三金属元素Z和Y能形成两种化合物,则Z是Na元素,Y是O元素,W是S元素,X是H元素,
(1)由O与Na形成的化合物Na2O2的电子式: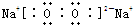 ,二氧化硫具有还原性,双氧水具有氧化性,二者能发生氧化还原反应生成硫酸,反应方程式:H2O2+SO2=H2SO4,
,二氧化硫具有还原性,双氧水具有氧化性,二者能发生氧化还原反应生成硫酸,反应方程式:H2O2+SO2=H2SO4,
故答案为: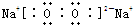 ;H2O2+SO2=H2SO4;
;H2O2+SO2=H2SO4;
(2)用离子方程式表示只含H、Na、S三种元素的化合物是亚硫酸氢钠,亚硫酸氢钠是强碱弱酸酸式盐,亚硫酸氢根离子水解而使其溶液呈碱性,水解方程式为:HSO3-+H2O=H2SO3+OH-,
故答案为:亚硫酸氢钠是强碱弱酸酸式盐,亚硫酸氢根离子水解而使其溶液呈碱性;
(3)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体,则两种化合物分别是亚硫酸氢钠和硫酸氢钠,二者反应的离子方程式为:H++HSO3-=H2O+SO2↑,
故答案为:H++HSO3-=H2O+SO2↑;
(4)X、Y两种元素的单质分别是氢气和氧气,氢氧燃料电池中,通入氢气的电极是负极,通入氧气的电极是正极,负极上氢气失电子发生氧化反应,正极上氧气得电子发生还原反应,所以①a是装置的负极,②b极是正极,正极上的电极反应式是O2+4e-+2H2O=4OH-,
故答案为:负;O2+4e-+2H2O=4OH-.
(1)由O与Na形成的化合物Na2O2的电子式:
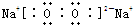 ,二氧化硫具有还原性,双氧水具有氧化性,二者能发生氧化还原反应生成硫酸,反应方程式:H2O2+SO2=H2SO4,
,二氧化硫具有还原性,双氧水具有氧化性,二者能发生氧化还原反应生成硫酸,反应方程式:H2O2+SO2=H2SO4,故答案为:
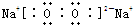 ;H2O2+SO2=H2SO4;
;H2O2+SO2=H2SO4;(2)用离子方程式表示只含H、Na、S三种元素的化合物是亚硫酸氢钠,亚硫酸氢钠是强碱弱酸酸式盐,亚硫酸氢根离子水解而使其溶液呈碱性,水解方程式为:HSO3-+H2O=H2SO3+OH-,
故答案为:亚硫酸氢钠是强碱弱酸酸式盐,亚硫酸氢根离子水解而使其溶液呈碱性;
(3)有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体,则两种化合物分别是亚硫酸氢钠和硫酸氢钠,二者反应的离子方程式为:H++HSO3-=H2O+SO2↑,
故答案为:H++HSO3-=H2O+SO2↑;
(4)X、Y两种元素的单质分别是氢气和氧气,氢氧燃料电池中,通入氢气的电极是负极,通入氧气的电极是正极,负极上氢气失电子发生氧化反应,正极上氧气得电子发生还原反应,所以①a是装置的负极,②b极是正极,正极上的电极反应式是O2+4e-+2H2O=4OH-,
故答案为:负;O2+4e-+2H2O=4OH-.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目