题目内容
Ⅰ.现有A、B、C、D、E五种强电解质,它们在水中可电离产生出下表所列的各种阴、阳离子(注意各种离子不能重复):
已知:
①用pH试纸检验A、B两溶液呈碱性;而C、D、E三溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(注:沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C溶液只能与D溶液反应产生沉淀.
请回答下列问题:
(1)写出A溶液呈碱性的原因(用离子方程式表示):______.
(2)向含1molE的溶液中逐滴加入B,以n(B)为横坐标以n(沉淀)为纵坐标.请在图中画出相应的图象:
(3)写出C溶液与D溶液反应的离子方程式:______.
Ⅱ.已知短周期元素X、Y、Z的原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族.请回答下列问题:
(1)能证明Y2ZX3溶液显碱性,且在溶液中存在水解平衡的事实是______(填序号).
a.滴入酚酞溶液变红,再加入稀H2SO4红色褪去
b.滴入酚酞溶液变红,再加入氯水红色褪去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色褪去
(2)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):
Cu2Z
澄清溶液
悬浊液
Cu2X
已知Cu2X与浓硝酸反应有红棕色气体生成,则该反应的化学反应方程式是:______.
(3)某温度下,在一个5L的密闭容器中充入0.2molZX2和0.1molX2,20s后达到平衡,测得容器中含有0.18molZX3,则用X2的浓度变化来表示该反应的平均速率是:v(X2)=______;此温度下该反应的化学平衡常数K=______(要求带单位).
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
①用pH试纸检验A、B两溶液呈碱性;而C、D、E三溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(注:沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C溶液只能与D溶液反应产生沉淀.
请回答下列问题:
(1)写出A溶液呈碱性的原因(用离子方程式表示):______.
(2)向含1molE的溶液中逐滴加入B,以n(B)为横坐标以n(沉淀)为纵坐标.请在图中画出相应的图象:

(3)写出C溶液与D溶液反应的离子方程式:______.
Ⅱ.已知短周期元素X、Y、Z的原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,X、Z在同一主族.请回答下列问题:
(1)能证明Y2ZX3溶液显碱性,且在溶液中存在水解平衡的事实是______(填序号).
a.滴入酚酞溶液变红,再加入稀H2SO4红色褪去
b.滴入酚酞溶液变红,再加入氯水红色褪去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色褪去
(2)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):
Cu2Z
| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
已知Cu2X与浓硝酸反应有红棕色气体生成,则该反应的化学反应方程式是:______.
(3)某温度下,在一个5L的密闭容器中充入0.2molZX2和0.1molX2,20s后达到平衡,测得容器中含有0.18molZX3,则用X2的浓度变化来表示该反应的平均速率是:v(X2)=______;此温度下该反应的化学平衡常数K=______(要求带单位).
Ⅰ.①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生,A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3;
(1)Na2CO3溶液呈碱性的原因(用离子方程式表示)为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(2)向含1molAl2(SO4)3的溶液中逐滴加入Ba(OH)2,开始发生反应:Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓,1molAl2(SO4)3完全反应消耗3molBa(OH)2,生成3molBaSO4、2molAl(OH)3,沉淀最大为5mol,然后发生反应Ba(OH)2+2Al(OH)3=Ba(AlO2)2+4H2O,2molAl(OH)3完全溶解消耗1molBa(OH)2,此时沉淀为3molBaSO4,再滴加Ba(OH)2,沉淀不发生变化,沉淀的量随Ba(OH)2物质的量变化关系为: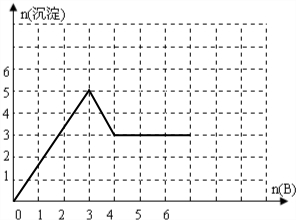 ,故答案为:
,故答案为: ;
;
(3)C溶液与D溶液反应的离子方程式为Cl-+Ag+=AgCl↓,故答案为:Cl-+Ag+=AgCl↓;
Ⅱ.短周期元素X、Y、Z的原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,Y处于ⅠA族,X、Z在同一主族,则X、Z最外层电子数=
=6,可推知X为O元素、Z为S元素,结合原子序数可知,Y为Na.
(1)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡;
a.滴入酚酞试液变红,说明溶液呈碱性,酚酞在pH大于8时,呈红色,加入硫酸溶液后,溶液褪色,溶液可能呈酸性越可能呈碱性,若为酸性,不能说明平衡移动,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故a错误;
b.滴入酚酞试液变红,再加入氯水后,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使红色褪色,氯气具有强氧化性,Cl2+SO32-+H2O═SO42-+2Cl-+2H+,Cl2+HSO3-+H2O═SO4 2-+2Cl-+3H+,溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故b错误;
c.滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在SO32-+H2O?HSO3-+OH-水解平衡,故c正确,
故答案为:c;
(2)Cu2X为氧化亚铜,Cu2O与浓硝酸反应生成红棕色的气体为NO2,该反应的方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O,
故答案为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;
(3)某温度下,在一个5L的密闭容器中充入0.2molSO2和0.1molO2,20s后达到平衡,测得容器中含有0.18molSO3,则SO2的起始浓度=
=0.04mol/L,O2的起始浓度=
=0.02mol/L,平衡时SO3的浓度=
=0.036mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):0.04 0.02 0
转化(mol/L):0.036 0.018 0.036
平衡(mol/L):0.004 0.002 0.036
故v(O2)=
=9×10-4mol/(L?S);
此温度下该反应的化学平衡常数K=
=4.05×104L/mol,
故答案为:9×10-4mol/(L?S);4.05×104L/mol.
②A溶液与E溶液反应既有气体又有沉淀产生,A溶液与C溶液反应只有气体产生,则A为Na2CO3,B为Ba(OH)2,E为Al2(SO4)3,C为HCl;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3;
(1)Na2CO3溶液呈碱性的原因(用离子方程式表示)为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
(2)向含1molAl2(SO4)3的溶液中逐滴加入Ba(OH)2,开始发生反应:Al2(SO4)3+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓,1molAl2(SO4)3完全反应消耗3molBa(OH)2,生成3molBaSO4、2molAl(OH)3,沉淀最大为5mol,然后发生反应Ba(OH)2+2Al(OH)3=Ba(AlO2)2+4H2O,2molAl(OH)3完全溶解消耗1molBa(OH)2,此时沉淀为3molBaSO4,再滴加Ba(OH)2,沉淀不发生变化,沉淀的量随Ba(OH)2物质的量变化关系为:
 ,故答案为:
,故答案为: ;
;(3)C溶液与D溶液反应的离子方程式为Cl-+Ag+=AgCl↓,故答案为:Cl-+Ag+=AgCl↓;
Ⅱ.短周期元素X、Y、Z的原子序数依次递增,X、Y、Z的最外层电子数之和为13,Y是所在周期中金属性最强的,Y处于ⅠA族,X、Z在同一主族,则X、Z最外层电子数=
| 13-1 |
| 2 |
(1)如果亚硫酸钠不水解,则溶液中氢氧根离子和氢离子浓度相等,溶液呈中性,向溶液中加入酚酞后溶液不变色,加入和亚硫酸根离子反应的物质后,溶液红色褪色,则证明存在水解平衡;
a.滴入酚酞试液变红,说明溶液呈碱性,酚酞在pH大于8时,呈红色,加入硫酸溶液后,溶液褪色,溶液可能呈酸性越可能呈碱性,若为酸性,不能说明平衡移动,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故a错误;
b.滴入酚酞试液变红,再加入氯水后,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使红色褪色,氯气具有强氧化性,Cl2+SO32-+H2O═SO42-+2Cl-+2H+,Cl2+HSO3-+H2O═SO4 2-+2Cl-+3H+,溶液褪色,不能说明存在SO32-+H2O?HSO3-+OH-水解平衡,故b错误;
c.滴入酚酞试液变红,说明溶液中氢氧根离子浓度大于氢离子浓度,再加入氯化钡溶液后,钡离子和亚硫酸根离子反应而和亚硫酸氢根离子不反应,钡离子和亚硫酸根离子反应生成亚硫酸钡沉淀,且溶液红色褪去,所以说明存在SO32-+H2O?HSO3-+OH-水解平衡,故c正确,
故答案为:c;
(2)Cu2X为氧化亚铜,Cu2O与浓硝酸反应生成红棕色的气体为NO2,该反应的方程式为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O,
故答案为:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;
(3)某温度下,在一个5L的密闭容器中充入0.2molSO2和0.1molO2,20s后达到平衡,测得容器中含有0.18molSO3,则SO2的起始浓度=
| 0.2mol |
| 5L |
| 0.1mol |
| 5L |
| 0.18mol |
| 5L |
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):0.04 0.02 0
转化(mol/L):0.036 0.018 0.036
平衡(mol/L):0.004 0.002 0.036
故v(O2)=
| 0.018mol/L |
| 20s |
此温度下该反应的化学平衡常数K=
| (0.036mol/L)2 |
| (0.004mol/L)2×0.002mol/L |
故答案为:9×10-4mol/(L?S);4.05×104L/mol.

练习册系列答案
相关题目
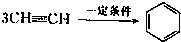 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.