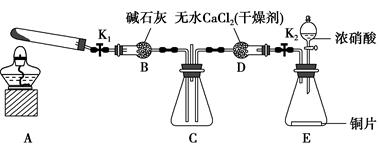
题目内容
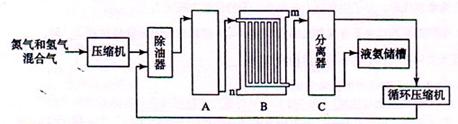
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:
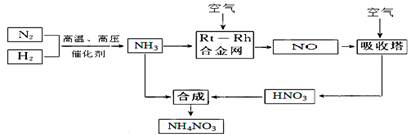
回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)="2.0" × 10-5 mol·L-1)。

回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)="2.0" × 10-5 mol·L-1)。
(1)  ;N2(g)+3H2 (g)
;N2(g)+3H2 (g)  2NH3 (g) △H="-34a" kJ/mol
2NH3 (g) △H="-34a" kJ/mol
(2)4NH3 + 5O2 4 NO+6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
4 NO+6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
(3)用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。(其他合理答案也可)
(4)NH4++ H2O NH3 ·H2O +H+;(5)逆向 x/200y mol·L-1
NH3 ·H2O +H+;(5)逆向 x/200y mol·L-1
 ;N2(g)+3H2 (g)
;N2(g)+3H2 (g)  2NH3 (g) △H="-34a" kJ/mol
2NH3 (g) △H="-34a" kJ/mol (2)4NH3 + 5O2
 4 NO+6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。
4 NO+6H2O ;合成氨正反应放热,低温有利于提高转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。(其他合理答案也可)
(4)NH4++ H2O
 NH3 ·H2O +H+;(5)逆向 x/200y mol·L-1
NH3 ·H2O +H+;(5)逆向 x/200y mol·L-1试题分析:(1)在氮气分子中两个N原子共用三对电子,所以N2的电子式是
 ;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)
;根据题意可得合成氨气的反应的热化学方程式为N2(g)+3H2 (g)  2NH3 (g) △H="-34a" kJ/mol ;(2)氨在催化剂表面被氧化为NO。该催化氧化的化学方程式是4NH3 + 5O2
2NH3 (g) △H="-34a" kJ/mol ;(2)氨在催化剂表面被氧化为NO。该催化氧化的化学方程式是4NH3 + 5O2  4 NO+6H2O ; 由于合成氨正反应是放热反应,所以从平衡角度看低温有利于提高反应物的转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)若输送NH3的管道某处发生泄漏,检测的简单方法是用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。或用蘸有浓盐酸的玻璃棒靠近,有白烟产生。(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,这是因为硝酸铵是强酸弱碱盐。该盐会发生水解反应:NH4++ H2O
4 NO+6H2O ; 由于合成氨正反应是放热反应,所以从平衡角度看低温有利于提高反应物的转化率,但反应速率过慢,故合成氨采用高温(400℃-500℃);正反应体积缩小,增大压强有利于提高转化率(正向移动),故采用高压(10 MPa -30MPa)。(3)若输送NH3的管道某处发生泄漏,检测的简单方法是用润湿的红色石蕊试纸检测,试纸变蓝的位置即是氨气泄漏处。或用蘸有浓盐酸的玻璃棒靠近,有白烟产生。(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,这是因为硝酸铵是强酸弱碱盐。该盐会发生水解反应:NH4++ H2O  NH3 ·H2O +H+,消耗了水电离产生的OH-,破坏了水的大量平衡,水会继续电离,当最终达到电离平衡时c(H+)>c(OH-),所以溶液显酸性。(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水电离产生铵根离子和OH-,会对水的电离起抑制作用。所以滴加氨水过程中水的电离平衡将逆向移动。在该溶液中,存在电荷守恒c(NH4+)+(H+)=c(NO3-)+c(OH-).由于溶液为中性,所以c(NH4+)=c(NO3-)。由于Kb(NH3·H2O)="2.0" × 10-5 mol/L,即
NH3 ·H2O +H+,消耗了水电离产生的OH-,破坏了水的大量平衡,水会继续电离,当最终达到电离平衡时c(H+)>c(OH-),所以溶液显酸性。(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水电离产生铵根离子和OH-,会对水的电离起抑制作用。所以滴加氨水过程中水的电离平衡将逆向移动。在该溶液中,存在电荷守恒c(NH4+)+(H+)=c(NO3-)+c(OH-).由于溶液为中性,所以c(NH4+)=c(NO3-)。由于Kb(NH3·H2O)="2.0" × 10-5 mol/L,即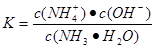 ,所以c(NH3·H2O)= c(NH4+)·c(OH-) /Kb={(x÷y)×10-7}÷2.0 × 10-5 mol/L=" x/200y" mol/L。
,所以c(NH3·H2O)= c(NH4+)·c(OH-) /Kb={(x÷y)×10-7}÷2.0 × 10-5 mol/L=" x/200y" mol/L。
练习册系列答案
相关题目
 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。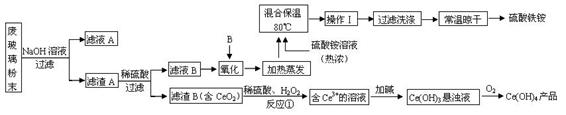
 、
、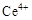 两种主要存在形式,
两种主要存在形式,