题目内容
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
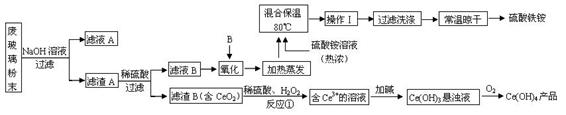
已知:
ⅰ.酸性条件下,铈在水溶液中有 、
、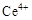 两种主要存在形式,
两种主要存在形式, 易水解,
易水解,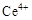 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。

滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。

已知:
ⅰ.酸性条件下,铈在水溶液中有
 、
、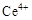 两种主要存在形式,
两种主要存在形式, 易水解,
易水解,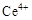 有较强氧化性。
有较强氧化性。ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。

滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
(1)冷却结晶,取少量溶液于试管中,加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,若试纸变蓝,则证明含有NH4+;(2)Fe3+、Fe2+;(3)2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O
(4)0.01mol,偏大;(5)Fe2(SO4)3·2(NH4)2SO4·2H2O
(4)0.01mol,偏大;(5)Fe2(SO4)3·2(NH4)2SO4·2H2O
试题分析:(1)根据示意图可知操作Ⅰ是冷却结晶,然后过滤、洗涤、干燥得到硫酸铁铵。检验硫酸铁铵溶液中含有NH4+的方法是取少量溶液于试管中,加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸,若试纸变蓝,则证明含有NH4+;或取少量溶液于试管中,加入NaOH溶液,加热,在试管口置一蘸有浓盐酸的玻璃棒,若有白烟产生,则证明含有NH4+;(2).反应①之前先要洗涤滤渣B,其目的是为了除去表面的杂质离子Fe3+、Fe2+;(3)由于Ce4+有较强氧化性反应,而H2O2有还原性,在酸性条件下反应。因此①的化学方程式2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,得到含有Ce3+的溶液。(4)滴定时所用定量仪器滴定管的读数精确为0.01ml; 若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则消耗的FeSO4溶液体积偏大,测定的该Ce(OH)4产品的质量分数就偏高;(5)第一份加入NaOH足量得到的固体Fe(OH)2, 烘干灼烧至恒重得到1.60g固体是Fe2O3。n(Fe2O3)="1.6g" ÷160 g/mol =0.01mol.n(Fe)=0.02mol;第二份中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应,则产生BaSO4沉淀。n(SO42-)=0.1L×0.5mol/L=0.05mol,根据电荷守恒可得n(NH4+)×1+0.02mol×3=0.05mol×2,解得n(NH4+)=0.04mol.n(H2O)= (7.00g-0.04mol×17g/mol-0.02mol×56g/mol-0.05mol× 96g/mol)÷ 18 g/mol =0.02mol.所以该晶体中n(Fe3+): n(NH4+): n(SO42-): n(H2O)="0.02:0.04:0.05:0,02=2:4:" 5:2.因此该晶体的化学式为Fe2(SO4)3·2(NH4)2SO4·2H2O。4+的检验、实验操作的目的、化学方程式的书写、滴定法在物质组成测定中的应用的知识。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
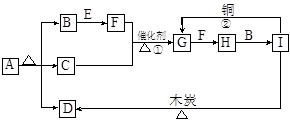
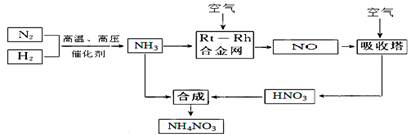
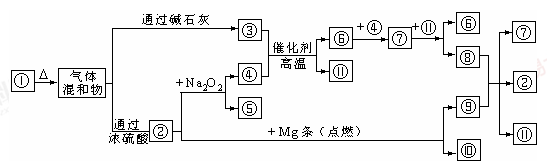
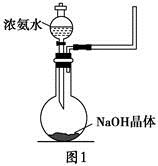

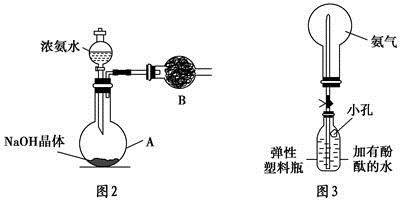
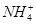 +OH-,NaOH晶体使该可逆反应的平衡向左移动
+OH-,NaOH晶体使该可逆反应的平衡向左移动