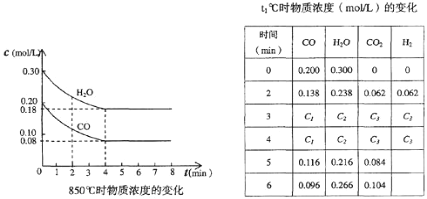
题目内容
【题目】将5.1g镁铝合金溶于70ml4mol/L硫酸中,当合金完全溶解后,再加入70ml8mol/L的NaOH溶液,得沉淀的质量为13.6g,则加入硫酸时,产生H2的物质的量为
A. 0.2mol B. 0.25mol C. 0.3mol D. 0.35mol
【答案】B
【解析】发生反应的离子方程式分别是2Al+6H+=2Al3++3H2↑,Mg+2H+=Mg2++H2↑,(H++OH-=H2O),Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,(Al(OH)3+OH-=AlO2-+2H2O),假设沉淀达到最大,溶液中的溶质为Na2SO4,溶液中n(Na+)正好是n(SO42-)的2倍,说明假设正确,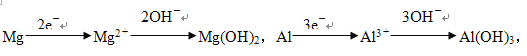
金属失去电子的物质的量等于得到OH-的物质的量,金属失去电子的物质的量等于H+得到电子的物质的量,因此有n(H2)×2=(13.6-5.1)/17,解得n(H2)=0.25mol,故选项B正确。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片
请帮助他们完成以下实验报告:
序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
实验2 | ④ | 在FeCl2溶液中加入锌片 |
| ⑤ | Zn +Fe2+= Zn2++Fe |
实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
填空:
(1)①_____________③____________ ⑤____________⑧____________
综合以上实验,你能得到的结论是:Fe3+有氧化性;_________________。
(2)亚铁盐溶液易被氧化,短时间保存亚铁盐溶液时为防止亚铁盐被氧化可在溶液中加入少量______________(填试剂名称)。
(3)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可):________。
(4)某同学向FeCl2溶液中加入Na2O2,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是___。