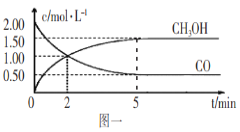
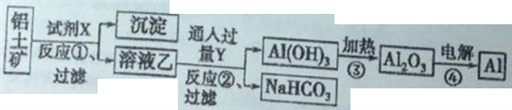
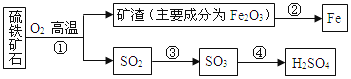
题目内容
【题目】为验证浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,设计如下实验:

(1)写出浓硫酸与木炭粉反应的化学方程式_____________。
(2)B中加入的试剂是_____,现象是______;C的作用是____,E的作用是________。
(3)如果将F放在B、C之间,则一定不能检出的物质是_______。
【答案】C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O无水硫酸铜固体由白色变为蓝色验证SO2的存在检验SO2是否被除干净CO2
CO2↑+2SO2↑+2H2O无水硫酸铜固体由白色变为蓝色验证SO2的存在检验SO2是否被除干净CO2
【解析】本题考查化学实验中实验设计的评价,(1)利用浓硫酸的强氧化性,与木炭反应的方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O ;(2)实验目的是验证木炭与浓硫酸反应产物,从反应方程式中得出产物是CO2、SO2、H2O,先验证水蒸气的存在,一般用无水CuSO4,白色变为蓝色,说明产生水,SO2能能使品红褪色,利用SO2的漂白性,因此C的作用是验证SO2的存在,SO2也能使澄清石灰水变浑浊,必须除去,同时验证是否除尽,因此装置E的作用是验证SO2是否被除净;(3)SO2也能使澄清石灰水变浑浊,CO2不能使品红或酸性高锰酸钾溶液褪色,因此F在B、C之间不能检出CO2.
CO2↑+2SO2↑+2H2O ;(2)实验目的是验证木炭与浓硫酸反应产物,从反应方程式中得出产物是CO2、SO2、H2O,先验证水蒸气的存在,一般用无水CuSO4,白色变为蓝色,说明产生水,SO2能能使品红褪色,利用SO2的漂白性,因此C的作用是验证SO2的存在,SO2也能使澄清石灰水变浑浊,必须除去,同时验证是否除尽,因此装置E的作用是验证SO2是否被除净;(3)SO2也能使澄清石灰水变浑浊,CO2不能使品红或酸性高锰酸钾溶液褪色,因此F在B、C之间不能检出CO2.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目