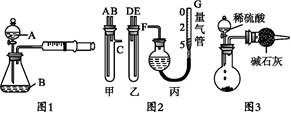
题目内容
氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下: 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
| A.定容摇匀后发现液面低于刻度线 |
| B.定容时俯视容量瓶的刻度线 |
| C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
| D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
(1)烧杯、100ml容量瓶(各1分,多写1个扣1分,容量瓶没有写规格0分);50(2分);CD(2分、写对一个得1分,写错一个0分)
(2)CaCO3+2H+=Ca2++H2O+CO2↑(2分);Al2O3+6H+=2Al3++3H2O(2分);Fe2O3+6H+=2Fe3++3H2O(2分);
(3)Al(OH)3+OH-=AlO2-+2H2O(2分)
(4)Al(OH)3、Fe(OH)3(2分、写对一个得1分,写错一个0分)
(5)蒸发浓缩,冷却结晶(各1分)
(6)洗涤、干燥(各1分);87%(2分);洗涤时,有少量的碳酸钙溶解(2分)
解析试题分析:(1)要配制100ml6mol/L的盐酸,所需的玻璃仪器除了玻璃棒、量筒、胶头滴管外,还需要稀释用到的烧杯,转移时用到的100ml容量瓶。由于在稀释过程中溶质的质量不变,所以还需要量取36.5%的盐酸的体积为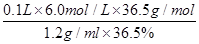 =50ml。根据cB=
=50ml。根据cB=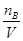 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此可以判断。A、定容摇匀后发现液面低于刻度线属于正确现象,浓度不变;B、定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积减少,浓度偏高;C、将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作,则溶质的物质的量减少,测定结果偏低;D、如果加水超过了刻度线,取出少量水使液面恰好到刻度线,则导致溶质的物质的量减少,测定结果偏低,因此正确的答案选CD。
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此可以判断。A、定容摇匀后发现液面低于刻度线属于正确现象,浓度不变;B、定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积减少,浓度偏高;C、将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作,则溶质的物质的量减少,测定结果偏低;D、如果加水超过了刻度线,取出少量水使液面恰好到刻度线,则导致溶质的物质的量减少,测定结果偏低,因此正确的答案选CD。
(2)由于碳酸钙、氧化铁、氧化铝均能和盐酸反应,所以步骤Ⅰ中有关反应的离子方程式有CaCO3+2H+=Ca2++H2O+CO2↑、Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)由于氢氧化铝是两性氢氧化物,能溶于强碱溶液中。所以步骤Ⅱ控制石灰水用量的目的是防止氢氧化钙过量溶解生成的氢氧化铝,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(4)由于溶液中的Al3+、Fe3+均和氢氧化钙反应生成Al(OH)3、Fe(OH)3沉淀,因此滤渣的主要成分是Al(OH)3、Fe(OH)3。
(5)步骤Ⅴ的主要目的是得到氯化钙晶体,所以所含的操作依次是蒸发浓缩,冷却结晶。
(6)沉淀过滤出来后需要洗涤并干燥。4.3g碳酸钙的物质的量=4.3g÷100g/mol=0.043mol,根据原子守恒可知氯化钙的物质的量也是0.043mol,则氯化钙的质量=0.043mol×111g/mol=4.773g,因此氯化钙的纯度=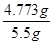 ×100%=86.78%。碳酸钙不溶于水是相对的,不可能绝对不溶。由于在洗涤时,有少量的碳酸钙溶解,从而导致测定结果偏低。
×100%=86.78%。碳酸钙不溶于水是相对的,不可能绝对不溶。由于在洗涤时,有少量的碳酸钙溶解,从而导致测定结果偏低。
考点:考查一定物质的量浓度的配制与计算、物质的分离与提纯、纯度计算以及误差分析

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案有关钴和铁化合物的性质见下表:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH) 2 | 5.9×10-15 | 9.4 | CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
| Fe(OH) 2 | 1.6×10-14 | 9.6 | |
| Fe(OH) 3 | 1.0×10-35 | x |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑工艺流程如下:
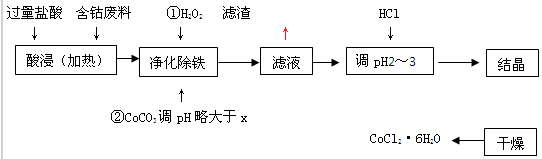
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全。试计算室温下,Fe(OH) 3沉淀完全时,则x= 。
(3)②步中用CoCO3调pH略大于x的原因是 。
(4)滤液中所含溶质有 , 。
(5)为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是 , 。
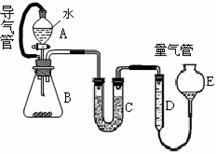
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| | 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
| 甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
实验需要0.1 mol/L NaOH溶液450 mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有___ ___
_______________________________________________ __________。
(2)根据计算得知,所需NaOH的质量为________g。
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
| A.称量时用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有________。
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。 
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有 。
(2)试剂X是
(3)步骤Ⅱ中发生反应的离子方程式是:_______________________________________
(4)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个 ________________________________________。
(5)溶液D中各离子的浓度由大到小的顺序为:__________________________________
(6)工业上由X和F制得CuSO4,还必须使用的最恰当的试剂可以是_____或_________。
| A.浓H2SO4 | B.Fe2O3 | C.HNO3 | D.O2 E.H2O2 |
(一)(4分)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3) (2)Cl2(HCl)
(3)FeCl3(FeCl2) (4)NaHCO3溶液(Na2CO3)
(二)(6分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示: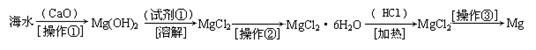
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式 ;
操作①主要是指 ;试剂①可选用 ;
操作②是指 ;经操作③最终可得金属镁。
(三)(8分)实验室配制480ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g。
(2)如图所示的仪器配制溶液肯定不需要的是 (填序号),本实验所需玻璃仪器E规格为 mL。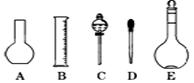
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的 。(填数字符号)
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是 。(填写字母,每种仪器只能选择一次)
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了 种用途。(填写数字)
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
| A.配制前没有将容量瓶中的水除尽; |
| B.碳酸钠失去了部分结晶水; |
| C.碳酸钠晶体不纯,其中混有氯化钠; |
| D.称量碳酸钠晶体时所用砝码生锈; |
可以用分液漏斗分离的一组混合物是
| A.酒精和碘 | B.苯和水 | C.乙酸和水 | D.溴和四氯化碳 |