题目内容
19.下列实验操作不能达到实验目的是( )| A. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| B. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| C. | 用饱和Na2CO3溶液鉴别乙酸、乙醇、硝基苯 | |
| D. | 利用燃烧的方法鉴别羊毛和棉花 |
分析 A.乙烯能被酸性高锰酸钾溶液氧化,乙烷不能被酸性高锰酸钾溶液氧化;
B.葡萄糖和新制氢氧化铜悬浊液反应生成砖红色沉淀必须在碱性条件下;
C.乙酸和碳酸钠反应生成二氧化碳,乙醇和碳酸钠互溶,硝基苯和碳酸钠不互溶;
D.羊毛的成分是蛋白质,棉花的成分是纤维素,蛋白质灼烧时有烧焦羽毛的气味.
解答 解:A.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烷不能被酸性高锰酸钾溶液氧化,所以现象不同,可以鉴别,故A正确;
B.葡萄糖和新制氢氧化铜悬浊液反应生成砖红色沉淀必须在碱性条件下,所以在滴加新制氢氧化铜悬浊液之前必须滴加NaOH溶液中和未反应的酸,故B错误;
C.乙酸和碳酸钠反应生成二氧化碳,乙醇和碳酸钠互溶,硝基苯和碳酸钠不互溶,所以现象不同,可以鉴别,故C正确;
D.羊毛的成分是蛋白质,棉花的成分是纤维素,蛋白质灼烧时有烧焦羽毛的气味,二者灼烧时现象不同,可以鉴别,故D正确;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、物质鉴别,明确实验原理及基本操作即可解答,易错选项是B,注意该反应条件必须是碱性条件下.

练习册系列答案
相关题目
10.Ⅰ.为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论.
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.已知:
请回答:(1)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、5mol/L硝酸钠溶液、0.5mol/L硝酸钠溶液、0.1mol/L稀盐酸、蒸馏水.
方案测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(2)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
①据实验现象写出发生反应的离子方程式:Cu+2Fe3+=Cu2++2Fe2+.
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
③解释乙同学的实验现象在此酸性条件下NO3-不能氧化Cu.
(3)请你设计更简便可行的实验方案,帮助甲同学达到实验目的将铜片放入0.5mol/L氯化铁溶液中.
Ⅱ.聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.505 0g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.100 0mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0g白色沉淀.(相对原子质量或式量:Fe-56 Al-27 Cl-35.5 O-16 H-1 Fe2O3-160 Al2O3-102 AgCl-143.5 H2O-18)
(4)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将偏低(填“偏高”“偏低”或“不变”).
(5)通过计算确定PAFC的化学式[FeAl3(OH)9Cl3•3H2O]m或FeAl3(OH)9Cl3•3H2O(写出计算过程;不要求写出反应方程式;m为聚合度,不必求出).
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、5mol/L硝酸钠溶液、0.5mol/L硝酸钠溶液、0.1mol/L稀盐酸、蒸馏水.
方案测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(2)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
③解释乙同学的实验现象在此酸性条件下NO3-不能氧化Cu.
(3)请你设计更简便可行的实验方案,帮助甲同学达到实验目的将铜片放入0.5mol/L氯化铁溶液中.
Ⅱ.聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.505 0g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.100 0mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0g白色沉淀.(相对原子质量或式量:Fe-56 Al-27 Cl-35.5 O-16 H-1 Fe2O3-160 Al2O3-102 AgCl-143.5 H2O-18)
(4)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将偏低(填“偏高”“偏低”或“不变”).
(5)通过计算确定PAFC的化学式[FeAl3(OH)9Cl3•3H2O]m或FeAl3(OH)9Cl3•3H2O(写出计算过程;不要求写出反应方程式;m为聚合度,不必求出).
7.下列实验操作和对应的现象、结论都正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
14.NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1的NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )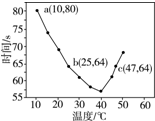

| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
11.燃烧0.1mol 两种气态烃的混合物,生成3.58L CO2(标准状况)和3.60g H2O,则混合气体中( )
| A. | 一定有甲烷 | B. | 一定有乙烷 | C. | 一定无甲烷 | D. | 可能有乙烯 |
6.下列物质中,不能由单质直接化合生成的是:( )
(1)CuS (2)FeS (3)SO3 (4)H2S (5)FeCl2 (6)H2Te.
(1)CuS (2)FeS (3)SO3 (4)H2S (5)FeCl2 (6)H2Te.
| A. | (1)(3)(5)(6) | B. | (1)(2)(3)(5) | C. | (1)(2)(4)(5) | D. | 全部 |
 2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196 KJ/mol。平衡时容器内气体压强为起始时的90%。此时 SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9,
SO2、bmol O2、cmol SO3(g),欲使平衡时SO3的体积分数为2/9, b、c表示),
b、c表示),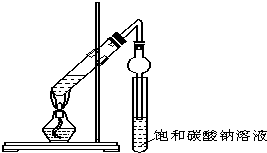 某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下图所示实验装置制取乙酸乙酯.回答以下问题: