题目内容
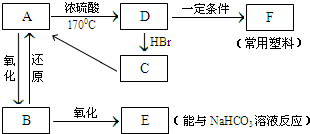
6.下列物质中,不能由单质直接化合生成的是:( )(1)CuS (2)FeS (3)SO3 (4)H2S (5)FeCl2 (6)H2Te.
| A. | (1)(3)(5)(6) | B. | (1)(2)(3)(5) | C. | (1)(2)(4)(5) | D. | 全部 |
分析 Fe、Cu都是变价金属,能和强氧化剂反应生成高价态化合物,和弱氧化剂反应生成低价态化合物,氯气具有强氧化性,S具有弱氧化性;S和氧气反应生成SO2;S和氢气反应生成相应的氢化物,Te和氢气不能直接化合,据此分析解答.
解答 解:(1)S具有弱氧化性,能将Cu氧化为低价态,所以和Cu反应生成Cu2S而不是CuS,故选;
(2)S具有弱氧化性,能将Fe氧化为低价态,所以和Fe反应生成FeS,故不选;
(3)在点燃条件下,S和氧气反应生成二氧化硫,二氧化硫和氧气在催化剂、加热条件下反应生成SO3,故选;
(4)在加热条件下,氢气和S反应生成H2S,故不选;
(5)氯气具有强氧化性,能将铁氧化生成FeCl3,故选;
(6)Te的非金属性很弱,不能和氢气直接化合生成H2Te,故选;
故选A.
点评 本题考查元素化合物知识,明确物质的性质是解本题关键,注意氯气、S单质和变价金属反应特点,注意:无论氯气是否过量,Fe在氯气中燃烧都生成氯化铁;无论氧气发生过量,S在氧气中燃烧都只生成二氧化硫,为易错点.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
19.下列实验操作不能达到实验目的是( )
| A. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| B. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| C. | 用饱和Na2CO3溶液鉴别乙酸、乙醇、硝基苯 | |
| D. | 利用燃烧的方法鉴别羊毛和棉花 |
14. 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),理由是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低(提示对比二者晶体类型及内部微粒作用力)
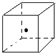
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子;
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)
计算该反应的反应热△H为+236 kJ/mol(要包含数据和焓变单位)
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),理由是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低(提示对比二者晶体类型及内部微粒作用力)
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子;
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)
计算该反应的反应热△H为+236 kJ/mol(要包含数据和焓变单位)
11.下列化学式只代表一种物质分子的是( )
| A. | CH2Cl2 | B. | C2H4Cl2 | C. | C4H10 | D. | C2H6O |
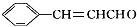 ,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3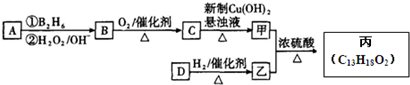
 .
. .
.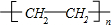 .
.