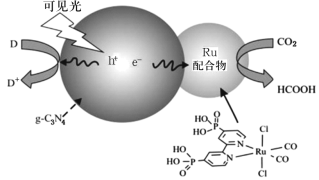
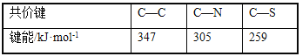
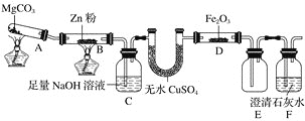
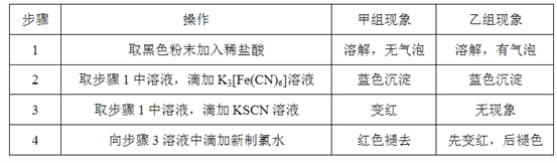
题目内容
【题目】高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:
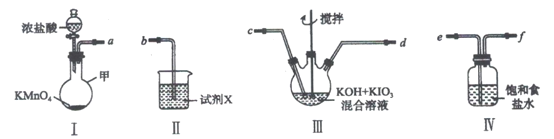
(1)装置I中盛放浓盐酸的仪器名称是___________。
(2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。
(3)装置Ⅱ中的试剂X的作用___________。
(4)上述炭置按气流由左至右各接口顺序为___________(用字母表示)。
(5)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。
①写出装置Ⅲ中发生反应的化学方程式:___________。
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。
③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取a g该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为b L。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O;KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O;I2+2Na2S2O3===2NaI+N2S4O6则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。
【答案】分液漏斗 16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑ 处理尾气氯气 aefcdb 2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失
KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失 ![]() 100%
100%
【解析】
装置I为氯气的发生装置,用于提供氯气来氧化碘酸钾制备高碘酸钾,装置I后接装置IV,用于除去挥发出的HCl气体,保证制备高碘酸钾的体系为碱性环境,而后接装置III,用于制备高碘酸钾,最后接装置II,用于处理尾气,装置II中应为NaOH溶液。
(1)装置I中盛放浓盐酸的仪器名称是分液漏斗;
(2)根据氧化还原反应得失电子守恒、电荷守恒、原子守恒,可写出装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑;
(3)根据分析,装置Ⅱ中的试剂X为NaOH,作用为尾气处理;
(4)根据分析,以及气体进入反应装置应当长导管进、短导管出,可写出接口顺序为aefcdb;
(5)①根据氧化还原反应得失电子守恒、电荷守恒、原子守恒,可写出装置Ⅲ中发生反应的化学方程式为2KOH+KIO3+Cl2![]() KIO4+2KCl+ H2O;
KIO4+2KCl+ H2O;
②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是可以降低KIO4的溶解度,减少晶体损失;
③由题意可知,滴定消耗的硫代硫酸钠的物质的量为b mol,所以碘单质的物质的量为0.5b mol,设样品中高碘酸钾的物质的量为x,碘酸钾的物质的量为y,![]() ,
,![]() ,解得
,解得![]() ,整理化简后可得该产品中KIO4的百分含量是
,整理化简后可得该产品中KIO4的百分含量是![]() 100%。
100%。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
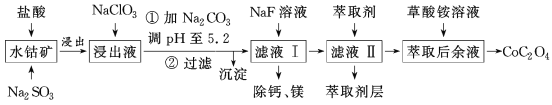
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
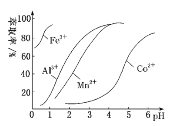
滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。