题目内容
【题目】常温下,pH相同的NaOH溶液和![]() 溶液分别加水稀释
溶液分别加水稀释![]() 随溶液体积变化的曲线如图所示,则下列叙述正确的是
随溶液体积变化的曲线如图所示,则下列叙述正确的是![]()
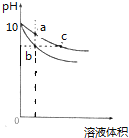
A. b、c两点溶液的导电能力相同
B. c点溶液中c![]()
C. a、b、c三点溶液中水的电离程度![]()
D. 等体积的b、c两点溶液分别与相同浓度的盐酸恰好完全反应时,消耗盐酸的体积相等
【答案】C
【解析】b点溶液中![]() +
+ ![]() ,c点溶液中
,c点溶液中![]() +
+ ![]() +c(CH3COO-),b、c两点溶液PH相同,即氢氧根离子浓度相同,所以c点溶液中离子浓度大于b,导电能力c>b,故A错误;根据质子守恒,c点溶液中c
+c(CH3COO-),b、c两点溶液PH相同,即氢氧根离子浓度相同,所以c点溶液中离子浓度大于b,导电能力c>b,故A错误;根据质子守恒,c点溶液中c![]() ,故B错误;b是氢氧化钠溶液,抑制水电离,b点水电离程度最小;a、c是醋酸钠溶液,促进水电离,a点浓度大于c,水电离
,故B错误;b是氢氧化钠溶液,抑制水电离,b点水电离程度最小;a、c是醋酸钠溶液,促进水电离,a点浓度大于c,水电离![]() ,所以a、b、c三点溶液中水的电离程度
,所以a、b、c三点溶液中水的电离程度![]() ,故C正确; 根据A项的分析,c点溶液醋酸钠浓度大于b点氢氧化钠,所以等体积的b、c两点溶液分别与相同浓度的盐酸恰好完全反应时,消耗盐酸的体积c>b,故D错误。
,故C正确; 根据A项的分析,c点溶液醋酸钠浓度大于b点氢氧化钠,所以等体积的b、c两点溶液分别与相同浓度的盐酸恰好完全反应时,消耗盐酸的体积c>b,故D错误。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
