��Ŀ����
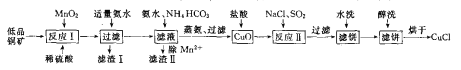
����Ŀ���Ȼ���ͭ��CuCl���㷺Ӧ���ڻ�����ӡȾ����Ƶ���ҵ��CuCl�����ڴ���ˮ���ڳ�ʪ��������ˮ��������������������Ũ�Ƚϴ����ϵ�д���CuCl+Cl-=[CuCl2]-����ҵ���õ�Ʒͭ����Ҫ��CuS��Cu2S��FeO�ȣ��Ʊ�CuCl��һ�ֹ����������£�
�ش��������⣺
��1����ӦI�б�������Ԫ����_________������Ԫ�ط��ţ�
��2������II�ijɷ���ҪΪMnCO3��д����Mn2+�����ڷ���ʽ_________��
��3��д����ӦII�з�����Ӧ�����ӷ���ʽ_________��
��4���ڽ��з�ӦIIʱ��ͨ���SO2һ�㶼Ҫ�ʵ�������Ŀ����_________��
��5���˱����д�ϴ��Ŀ����_________��
��6���ڽ��з�ӦIIʱ�����Ȼ����������ӵ�һ���̶Ⱥ��Ȼ���ͭ�ij����ʼ�С��ԭ����_________��
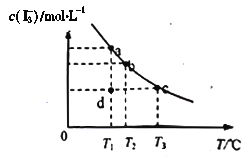
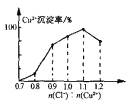
��7��Cu2+�ij�������ָת��ΪCuCl��n(Cu2+)ռ�ܵ�n(Cu2+)�İٷֱȡ���һ��������Cu2+�����������ǰ��Cl-��Cu2+�����ʵ���֮��[n(Cl-): n(Cu2+)]�Ĺ�ϵ����ͼ��ʾ��CuCl+Cl-![]() [CuCl2]-��ƽ�ⳣ��K=6.5��10-2�����������Cu2+����������Ϊ_________����������λС������
[CuCl2]-��ƽ�ⳣ��K=6.5��10-2�����������Cu2+����������Ϊ_________����������λС������
���𰸡� S��Cu��Fe Mn2+ + HCO3- + NH3��H2O ===MnCO3��+ NH4+ + H2O SO2 + 2Cu2+ + 2Cl- + 2H2O == 2CuCl��+SO42- + 4H+ ��CuCl2��ȫת��ΪCuCl����ֹCuCl������ ��ϴ�����ڼӿ��ȥCuCl����ˮ�֣�����ֹ��ˮ������� ����������Ũ�ȣ�CuCl+Cl-![]() [CuCl2]�Cƽ�������ƶ���ʹ���ɵ��Ȼ���ͭ�ֲ���ת��Ϊ[CuCl2]�C 99.39%
[CuCl2]�Cƽ�������ƶ���ʹ���ɵ��Ȼ���ͭ�ֲ���ת��Ϊ[CuCl2]�C 99.39%
����������Ʒͭ��(��Ҫ��CuS��Cu2S��FeO��)�ܽ���ϡ�����MnO2�Ļ����õ�Fe2(SO4)3��CuSO4��MnSO4�Ļ��Һ���μ�������ˮ������Һ�е�Fe3+�����˵�����IΪFe(OH)3���� Һ�еμӰ�ˮ��NH4HCO3��Һ��������Һ�е�Mn2+�����˵�������ΪMnCO3����Һ���������˵õ�CuO����CuO�ܽ���ϡ�����CuCl2��Һ���ټ���NaCl��Һ��ͨSO2���壬������Ӧ����CuCl���������ˡ�ˮϴ����ϴ����ɵ�CuCl��
(1)��ӦI����CuS��Cu2S��FeO�������������±�MnO2����������S��Cu��FeԪ�طֱ�����ΪSO42-��Cu2+��Fe3+��
(2)����Mn2+����Һ�еμӰ�ˮ��NH4HCO3������MnCO3��������Ӧ�����ڷ���ʽΪMn2+ + HCO3- + NH3��H2O ===MnCO3��+ NH4+ + H2O��
(3)��ӦII��SO2��Cu2+��ԭ����CuCl����������ΪSO42-��������Ӧ�����ӷ���ʽΪSO2 + 2Cu2+ + 2Cl- + 2H2O == 2CuCl��+SO42- + 4H+ ��
(4)CuCl�ױ���������SO2��ˮ��Һ�н�ǿ��ԭ�ԣ����ڽ��з�ӦIIʱ��ͨ���SO2�ʵ��������ɽ�CuCl2��ȫת��ΪCuCl����ֹCuCl��������
(5)�Ҵ��ӷ���CuCl�����ڴ������ô�ϴ�����ڼӿ��ȥCuCl����ˮ�֣�����ֹ��ˮ���������
(6)CuCl��������Ũ�Ƚϴ����ϵ�д���CuCl+Cl-=[CuCl2]-������������Ũ�ȣ�CuCl+Cl-![]() [CuCl2]�Cƽ�������ƶ���ʹ���ɵ��Ȼ���ͭ�ֲ���ת��Ϊ[CuCl2]�C��
[CuCl2]�Cƽ�������ƶ���ʹ���ɵ��Ȼ���ͭ�ֲ���ת��Ϊ[CuCl2]�C��
(7)��Cu2+����������Ϊx�������ǰ��Cl-��Cu2+�����ʵ���֮��[n(Cl-): n(Cu2+)]=1.1:1�������ǰCu2+Ϊ1mol��Cl-Ϊ1.1mol�����ɵ�CuClΪxmol��ʣ��Cl-Ϊ(1.1-x)mol����Cu2+Ϊ��������ʱ����Һ��Cl-�ӽ�Ϊ0.1mol�������ɵ�[CuCl2]-Ϊ(1.1-x-0.1)mol=(1-x)mol��ƽ��ʱCl-Ϊ[0.1-��1-x��]mol=��x-0.9��mol������ƽ��CuCl+Cl-![]() [CuCl2]-��֪ƽ�ⳣ��K=
[CuCl2]-��֪ƽ�ⳣ��K= =
=![]() =6.5��10-2�����x=99.39%��
=6.5��10-2�����x=99.39%��

 ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�����Ŀ��ͨ�����ǰѲ�1 molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ��ָ�����ѧ���ļ������£�
��ѧ�� | H��H | Cl��Cl | Cl��H |
����/(kJ��mol��1) | 436 | 243 | 431 |
�����H2(g)��Cl2(g) === 2HCl(g)�ķ�Ӧ��
A. ��862 kJ��mol��1 B. ��679 kJ��mol��1 C. ��183 kJ��mol��1 D. ��183 kJ��mol��1
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�أ�A��ԭ�Ӻ��������ӣ�B��F��Ԫ�����ڱ��е����λ�� ��ͼ��B����Ԫ�����γ�������ɫ���壬D�ǵؿ��к�������Ԫ�أ�E�ǵؿ��к������Ľ���Ԫ�ء�
B | ||
F |
��1��BF2�ĽṹʽΪ____________��
��2��D�� F�⻯���зе�ϸߵ�___________________�ѧʽ����
��3����ҵ��ȡE���ʵĻ�ѧ����ʽΪ______________��
��4�������ӹ�ҵ�У�C�������̬�⻯���ˮ��Һ������ʴ��H2O2�����������������Ӧ�IJ��ﲻ��Ⱦ�������仯ѧ����ʽΪ______________��
(5)���ʹ��B2A8C2��ȼ�ϣ�N2O4Ϊ��������ȼ�շų��ľ������ܰѻ������ ̫�գ����Ҳ�����������Ⱦ�����壬�仯ѧ����ʽΪ____________��