题目内容
【题目】碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空问构型为_______。
(3)有机物M( )在一定条件下生成N(
)在一定条件下生成N( )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解翻度低于SrCO3的原因_____________。
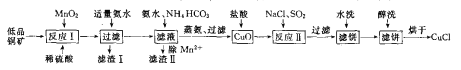
(5)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:

①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为am ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
【答案】 6 ![]() SO3或 NO3- 或SiO32- 平面三角形 小于 sp2、sp3 7:2 N > O > C Ca2+的离子半径小于Sr2+,Ca2+更易结合碳酸根离子中的氧离子,使碳酸根离子更易分解为二氧化碳 (1,1,1/2)
SO3或 NO3- 或SiO32- 平面三角形 小于 sp2、sp3 7:2 N > O > C Ca2+的离子半径小于Sr2+,Ca2+更易结合碳酸根离子中的氧离子,使碳酸根离子更易分解为二氧化碳 (1,1,1/2) 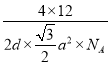
【解析】(1)碳原子核外电子有6个电子,则有6种不同的运动状态,碳原子的价电子排布式为2s22p2,在形成sp3杂化后,其轨道表达式为![]() ;
;
(2)CO32-中孤对电子![]() =0,价层电子对数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;原子个数相等、价电子数相等的微粒互为等电子体,CO32-的原子数为4,价电子数为24,其等电子体微粒的化学式有SO3或 NO3- 或SiO32-,它们和CO32-一样采取sp2杂化,空间构型为平面三角形;
=0,价层电子对数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;原子个数相等、价电子数相等的微粒互为等电子体,CO32-的原子数为4,价电子数为24,其等电子体微粒的化学式有SO3或 NO3- 或SiO32-,它们和CO32-一样采取sp2杂化,空间构型为平面三角形;
(3)①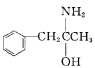 分子间存在氢键,则沸点:M小于N ;
分子间存在氢键,则沸点:M小于N ;
②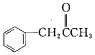 中苯环和羰基上碳原子杂化类型为sp2杂化,而亚甲基或甲基碳原子为sp3 杂化,不同杂化类型的碳原子数之比为7:2;
中苯环和羰基上碳原子杂化类型为sp2杂化,而亚甲基或甲基碳原子为sp3 杂化,不同杂化类型的碳原子数之比为7:2;
③有机物N中除氢原子之外还有C、N、O三种原子,因N原子2p轨道为半充满结构,相对稳定,三种原子的第一电离能由大到小的顺序为N > O > C;
(4)因Ca2+的离子半径小于Sr2+,Ca2+更易结合碳酸根离子中的氧离子,使碳酸根离子更易分解为二氧化碳,故CaCO3的热分解温度低于SrCO3;
(5)①由晶胞结构可知,C原子的y坐标和z坐标与B点相同,其x坐标数值为1,则C原子的坐标参数为(1,1, ![]() )
)
②已知石墨晶胞底边长为am ,底边面积为![]() ×
×![]() ×2=
×2=![]() cm2,晶胞的体积为
cm2,晶胞的体积为![]() cm2×2dcm=da2
cm2×2dcm=da2![]() cm3,晶胞中含有碳原子数4×
cm3,晶胞中含有碳原子数4×![]() +4×
+4×![]() +2×
+2×![]() +2×
+2×![]() +1+2×
+1+2×![]() =4,1mol晶胞的质量为4×12g,则石墨的密度为(4×12g)÷(NA×da2
=4,1mol晶胞的质量为4×12g,则石墨的密度为(4×12g)÷(NA×da2![]() cm3)=
cm3)= 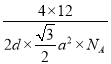 g·cm-3。
g·cm-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案