题目内容
7.(1)在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热.已知:H2O(l)=H2O(g)△H=+44kJ/mol,0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时,放出256.64kJ的热量.写出常温下肼和H2O2反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.6 kJ/mol(2)铜是重要的金属.胆矾(CuSO4•5H2O)是铜的重要化合物,有着广泛的应用.向CuSO4溶液中加入氨水至过量,可生成一种配合物.用离子方程式表达沉淀溶解形成配合物的过程Cu(OH)2+4 NH3=[Cu(NH3)4]2++2OH-.
(3)在探究浓度对速率的影响时用到酸性高锰酸钾与草酸反应,写出该反应的离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
分析 (1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=641.625 kJ•mol-1,因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,②H2O(l)═H2O(g)△H=+44kJ•mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ•mol-1;
(2)硫酸铜和氨水反应生成氢氧化铜沉淀,当氨水过量时,氨水和氢氧化铜反应生成铜氨溶液;硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物,根据反应写出离子反应方程式;根据胆矾溶液与足量氨水形成的深蓝色溶液中的阳离子为四氨合铜络离子;
(3)草酸和酸性高锰酸钾溶液发生氧化还原反应生成二氧化碳、锰离子和水.
解答 解:(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=641.625 kJ•mol-1,因①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,②H2O(l)═H2O(g)△H=+44kJ•mol-1,根据盖斯定律,①-②×4,得N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ•mol-1,故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.6 kJ/mol;
(2)硫酸铜和氨水反应生成氢氧化铜沉淀,当氨水过量时,氨水和氢氧化铜反应生成铜氨溶液,所以看到的现象是先生成蓝色沉淀后沉淀溶解,得到蓝色溶液;
氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3═[Cu(NH3)4]2++2OH-,故答案为:Cu(OH)2+4 NH3=[Cu(NH3)4]2++2OH-;
(3)发生氧化还原反应,生成锰离子、二氧化碳、水,该离子反应为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
点评 本题考查离子方程式和热化学方程式的书写,为考试高频点,根据草酸和高锰酸钾的性质确定生成物,题目难度不大.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | 一般都容易导电?导热 | B. | 都有金属光泽 | ||
| C. | 都具有较高的熔点 | D. | 一般都有延展性 |
| A. | HCl气体溶于水时破坏了非极性共价键 | |
| B. | 4.6gNO2溶于水转移0.3mol电子 | |
| C. | 碱金属元素的原子半径越大熔点越低 | |
| D. | 离子化合物和共价化合物在熔融状态下都可以导电 |
①NaOH;②AgNO3;③Na2CO3;④FeCl2.
| A. | 只有②③ | B. | 只有③④ | C. | 有①②③④ | D. | 只有②③④ |
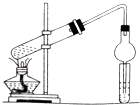 填空
填空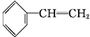 +Br2→
+Br2→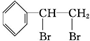 .
.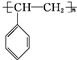 .A与氢气完全加成后的一氯代物共有6种.
.A与氢气完全加成后的一氯代物共有6种. .
.  如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,A是硝酸铜溶液(“-”相连两物质能发生反应).请回答:
如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,A是硝酸铜溶液(“-”相连两物质能发生反应).请回答: