题目内容
4.用含有少量镁的铝片制取纯净的Al(OH)3时,下列操作中最恰当的组合是( )①加盐酸溶解 ②加NaOH溶液溶解 ③过滤 ④通入过量的CO2生成Al(OH)3
⑤加盐酸生成Al(OH)3 ⑥加过量的烧碱生成Al(OH)3.
| A. | ①⑤⑥③ | B. | ①③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
分析 根据镁和铝化学性质的差异:铝可以与碱反应,让镁和铝分离的方法是使铝溶于氢氧化钠溶液,镁不溶解,过滤分离,再将偏铝酸钠与弱酸反应变为氢氧化铝.
解答 解:因镁与碱不反应,而铝可以与碱反应:2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,由于镁不溶解,过滤除去,NaAlO2要转变成Al(OH)3,可以向滤液中加入过量的二氧化碳,其反应为NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓,再过滤即得纯净的Al(OH)3,实验操作最合理的组合及顺序为②③④③,
故选C.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,涉及铝及其化合物的性质,注意NaAlO2制备氢氧化铝只能用弱酸不能强酸,因为强酸一旦过量,氢氧化铝会继续与强酸反应,与弱酸不反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.生物体中细胞内的葡萄糖,细胞膜外的富氧液体及细胞膜可构成微型生物原电池,下列有关判断正确的是( )
| A. | 负极发生的电极反应可能是:O2+4e-+2H2O═4OH - | |
| B. | 正极发生的电极反应可能是:O2+4e-═2O2- | |
| C. | 正极反应主要是:C6H12O6生成CO2或CO32- | |
| D. | 负极反应主要是:C6H12O6生成 CO2或 HCO3- |
12.下列所示的实验操作中,正确的是( )
| A. |  向试管内加锌粒 | B. |  向试管内倒液体 | ||
| C. |  给试管内的液体加热 | D. |  用橡胶塞塞住试管 |
9.铝热剂中铝的作用是( )
| A. | 催化剂 | B. | 氧化剂 | C. | 还原剂 | D. | 填充剂 |
16.A、B、C三种短周期元素,已知A元素的原子最外层电子数等于其电子层数,B元素的原子最外层电子数是其电子层数的2倍,C元素的原子最外层电子数是其电子层数的3倍.由这三种元素组成的化合物的化学式不可能是( )
| A. | A3BC2 | B. | A4B2C | C. | A8B3C3 | D. | A4B2C2 |
13.对下列化学用语的理解正确的是( )
| A. | 结构示意图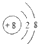 ,可以表示一种原子,也可以表示一种离子 ,可以表示一种原子,也可以表示一种离子 | |
| B. | 比例模型 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 可以表示二氧化碳分子,也可以表示二硫化碳分子分子 | |
| C. | 电子式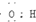 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 分子式C2H4O2:可以表示乙酸,也可以表示甲酸甲酯 |
14.下列各组物质中,互为同位素的是( )
| A. | T2O与D2O | B. | 4019K与4020C | C. | O2和O3 | D. | 21H和31H |