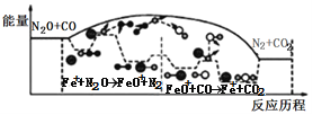
题目内容
【题目】下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。

回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有_____________;
(2)固体A的主要成分是________;
(3)进行步骤Ⅱ时,为了达到分离要求,加入的NaOH应该_____(填少量或过量)。
(4)进行步骤Ⅲ时,一般通入过量CO2,其反应的离子方程式是________;
(5)溶液X和盐酸反应的化学方程式为_______________________。
【答案】Fe3+、Al3+、H+ SiO2 过量 AlO2-+CO2+2H2O===HCO3-+Al(OH)3↓ NaHCO3+HCl===H2O+CO2↑+NaCl
【解析】
铝土矿主要成分是![]() ,含
,含![]() 、
、![]() 杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,所以固体A为
杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,所以固体A为![]() ,加入氢氧化钠的目的是分离铁离子和铝离子,应该加入过量的氢氧化钠,铁离子生成氢氧化铁沉淀,铝离子生成偏铝酸根,通入二氧化碳后偏铝酸根生成氢氧化铝沉淀,灼烧氢氧化铝生成氧化铝。
,加入氢氧化钠的目的是分离铁离子和铝离子,应该加入过量的氢氧化钠,铁离子生成氢氧化铁沉淀,铝离子生成偏铝酸根,通入二氧化碳后偏铝酸根生成氢氧化铝沉淀,灼烧氢氧化铝生成氧化铝。
(1)铝土矿主要成分是![]() ,含
,含![]() 、
、![]() 杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,且盐酸过量,故所得溶液中的阳离子有铝离子、铁离子和氢离子,
杂质,其中氧化铝、氧化铁能和盐酸反应,二氧化硅和盐酸不反应,且盐酸过量,故所得溶液中的阳离子有铝离子、铁离子和氢离子,
故答案为:![]() ;
;
(2)二氧化硅和盐酸不反应,所以固体A为![]() ,
,
故答案为:![]() ;
;
(3)加入氢氧化钠的目的是分离铁离子和铝离子,应该加入过量的氢氧化钠,铁离子生成氢氧化铁沉淀,铝离子生成偏铝酸根,
故答案为:过量;
(4)通入过量![]() 后,偏铝酸根生成氢氧化铝沉淀,
后,偏铝酸根生成氢氧化铝沉淀,![]() 过量所以生成碳酸氢根,离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
过量所以生成碳酸氢根,离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)溶液X为碳酸氢钠溶液,和盐酸反应的方程式为:NaHCO3+HCl=H2O+CO2↑+NaCl,
故答案为:NaHCO3+HCl=H2O+CO2↑+NaCl。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案