题目内容
【题目】将2.9 g镁铝合金投入到500 mL 2 mol/L的硫酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入NaOH溶液的体积是
A. 125 mL B. 200 mL C. 250 mL D. 500 mL
【答案】D
【解析】
镁铝合金与盐酸反应,金属完全溶解,反应生成MgCl2、AlCl3,加入4 mol/L的NaOH溶液,生成的沉淀最多时,Mg2+和Al3+全部转化为沉淀,溶液中的溶质只有NaCl,根据氯原子和钠原子守恒,可得n(NaOH) = 2 n(Na2SO4) = 2n(H2SO4),再根据c=![]() 计算。
计算。
由上述分析可知,n(NaOH) = 2 n(Na2SO4) = 2n(H2SO4)= 2 × 2 mol/L×0.5 L = 2 mol,故需要氢氧化钠溶液体积为![]() = 0.5 L = 500 mL,
= 0.5 L = 500 mL,
故答案选D。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
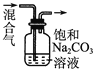
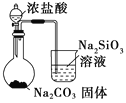
【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
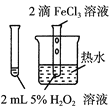
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
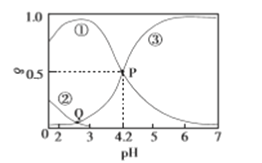
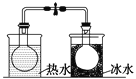
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D