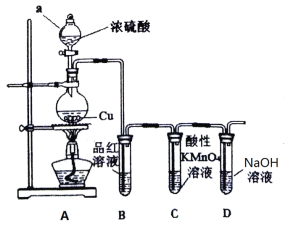
题目内容
【题目】在一定条件下,反应2A(g)+2B(g)![]() 3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
3C(g)+D(g)在恒容容器中进行,达到化学平衡的标志是( )
A. 单位时间内生成2n molB,同时消耗3n molCB. 容器内压强不随时间变化
C. 混合气体的密度不随时间变化D. B物质的百分含量不变
【答案】D
【解析】
A、单位时间里生成2n molB,同时消耗3n molC,都表示逆反应速率,二者始终都按2:3进行,所以不能判断平衡状态,故A错误;
B、该反应前后气体的物质的量不变,压强始终不变,压强不随时间改变,不能说明到达平衡状态,故B错误;
C、混合气体的总质量不变,容器的体积不变,混合气体的密度始终不变,气体的密度不随时间改变,不能说明到达平衡状态,故C错误;
D、化学反应达到平衡状态时,各物质的物质的量不变,百分含量不变,故D正确;
答案选D。

练习册系列答案
相关题目
【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c