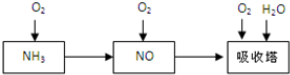
题目内容
5.硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.请回答下列问题:
(1)操作Ⅰ步骤是蒸发浓缩、冷却结晶、过滤、洗涤.
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解.
(3)加入Sn粉的作用有两个:①调节溶液pH ②防止Sn2+被氧化.
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是Sn2++CO32-═SnO↓+CO2↑.
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是Sn2++H2O2+2H+═Sn4++2H2O.
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,发生的反应为:
6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
取1.190g 锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液25.00mL.锡粉中锡的质量分数是75.00%.
分析 SnCl2在盐酸中溶解,再加入锡粉,溶解得到SnCl2溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体,
(1)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取加热浓缩、冷却结晶、冷却结晶、过滤、洗涤得到;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水;
(6)根据电子转移守恒与方程式可得关系式Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7,据此计算;
解答 解:SnCl2在盐酸中溶解,再加入锡粉,溶解得到SnCl2溶液加入碳酸钠沉淀锡离子,过滤得到沉淀洗涤后加入硫酸溶解得到硫酸锡溶液,蒸发浓缩冷却结晶,过滤洗涤得到硫酸锡晶体,
(1)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤;
(2)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解,
故答案为:SnCl2水解,发生SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(3)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
故答案为:防止Sn2+被氧化;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32-═SnO↓+CO2↑,
故答案为:Sn2++CO32-═SnO↓+CO2↑;
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
故答案为:Sn2++H2O2+2H+═Sn4++2H2O;
(6)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~$\frac{1}{3}$K2Cr2O7计算.
119g $\frac{1}{3}$mol
1.19g×x 0.100mol/L×0.025L
故$\frac{119g}{1.19g×x}$=$\frac{\frac{1}{3}mol}{0.100mol/L×0.025L}$
解得x=75.00%,
故答案为:75.00%.
点评 本题SnSO4制备的之比为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写、滴定应用及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求.

| A. | (m+4.8)g | B. | (m+5.1)g | C. | (m+10.2)g | D. | (m+19.2)g |
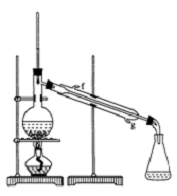 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:已知:
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①请书写A中环己醇制环己烯的化学反应方程式
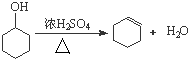 .
.②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,蒸馏时要加入生石灰,目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品B.环己醇实际用量多了C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是B、C.
A.用酸性高锰酸钾溶液B.用金属钠C.测定沸点.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)已知该反应反应物的总能量大于生成物的总能量,则该反应是放热(填“放热”或“吸热”)反应.
(3)用O2表示从0-2s内该反应的平均速率v(O2)=1.5×10-3mol•L-1•s-1.
(4)如图中表示c(NO2)随时间的变化曲线是b.
| A. | 新制氯水长期放置后会呈现浅黄绿色 | |
| B. | 长期放置的氯水也能使有色布条褪色 | |
| C. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| D. | 用氯气制漂白粉是为了得到易贮存的漂白剂 |
| A. | 稀硝酸 | B. | 铁粉 | C. | 氯水 | D. | 双氧水 |
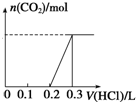 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,