题目内容
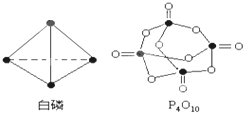 白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子.如图:
白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子.如图:化学反应可视为旧键断裂和新键形成的过程.现提供以下化学键的键能(kJ?mol-1).P-P键:198kJ?mol-1;P-O键:360kJ?mol-1;O=O键498kJ?mol-1;P=O键585kJ?mol-1.
(1)试根据这些数据,计算出以下反应的反应热△H的值:P4(白磷)+5O2═P4O10
(2)P4O10极易与水化合,反应过程可表示为如下形式:P-O-P+H2O→2P-OH.若每个P4O10分子与四个水分子发生化合反应,写出该反应的化学方程式
考点:反应热和焓变
专题:化学反应中的能量变化
分析:(1)先根据题中信息分析出P4O10的分子结构中含有的P-O键和P=O键个数,然后利用△H=反应物键能总和-生成物键能总和及题中数据计算出反应P4(s)+5O2(g)=P4O10(s)中的燃烧热.
(2)依据原子守恒写出化学方程式即可.
(2)依据原子守恒写出化学方程式即可.
解答:
解:(1)由P4的分子结构和P4(s)+5O2(g)=P4O10(s)的物质变化,在P4O10分子中只存在P-O和P=O两种共价键,P4O10中P显+5价、O显-2价等事实可知,在P4分子结构的基础上,每2个P原子之间插入1个O原子形成2个P-O键,每个P原子再结合1个O原子形成P=O键,就构成了P4O10的分子结构,所以在1个P4O10分子中共有12个P-O键、4个P=O键;则反应P4(s,白磷)+5O2(g)=P4O10(s)中的燃烧热为:
△H=反应物键能总和-生成物键能总和=6×198 kJ?mol-1+5×498 kJ?mol-1-(12×360kJ?mol-1+4×585kJ?mol-1)=-2982kJ?mol-1,
故答案为:-2982kJ?mol-1;
(2)据原子守恒,每个P4O10分子与四个水分子发生化合反应的方程式为:P4O10+4H2O=2H4P2O7,故答案为:P4O10+4H2O=2H4P2O7.
△H=反应物键能总和-生成物键能总和=6×198 kJ?mol-1+5×498 kJ?mol-1-(12×360kJ?mol-1+4×585kJ?mol-1)=-2982kJ?mol-1,
故答案为:-2982kJ?mol-1;
(2)据原子守恒,每个P4O10分子与四个水分子发生化合反应的方程式为:P4O10+4H2O=2H4P2O7,故答案为:P4O10+4H2O=2H4P2O7.
点评:本题考查热化学方程式书写、据键能求算反应热、据原子守恒书写化学方程式,题目有一定难度.

练习册系列答案
相关题目
25℃时,在1.0L浓度均为0.01mol?L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
| A、该溶液的pH<7 |
| B、c(A-)+c(HA)═0.02mol?L-1 |
| C、n(A-)+n(OH-)═0.01mol+n(H+) |
| D、HA的酸性很弱,A-的水解程度大于HA的电离程度 |
在下列条件下,可能大量共存的离子组是( )
| A、c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- |
| B、水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- |
| C、能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- |
| D、能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42- |
 材料是人类赖以生存与发展的重要物质基础,是时代进步的重要标志.
材料是人类赖以生存与发展的重要物质基础,是时代进步的重要标志.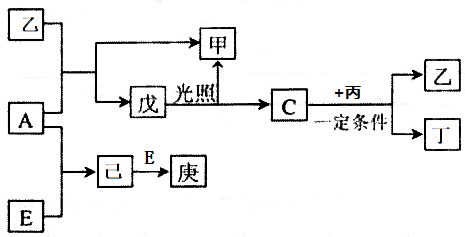
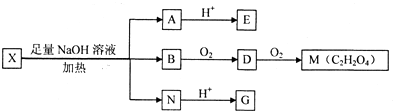
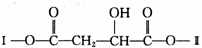 (其中I、Ⅱ为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、Ⅱ为未知部分的结构)为推测X的分子结构,进行如图的转化: