题目内容
12.2SO2+O2?2SO3△H<0是工业上接触法制硫酸的重要反应.下列关于该反应的说法不正确的是( )| A. | 增加O2的浓度提高SO2的转化率 | |
| B. | 利用该反应放出的热量对SO2、O2预热 | |
| C. | 降低温度能加快反应的速率 | |
| D. | 即使增大压强也不能使SO2全部转化为SO3 |
分析 A、增大一种反应物浓度,另一种反应物转化率增大;
B、该反应放热,反应放出的热量可以预热反应物;
C、降温反应速率减慢;
D、可逆反应不能完全转化为生成物.
解答 解:A.增加O2的浓度,平衡正向移动,二氧化硫转化率增大,故A正确;
B.工业生产中利用反应放出的热量对SO2、O2预热,故B正确;
C.降低温度,活化分子百分数减小,反应速率减小,故C错误;
D.可逆反应反应物不可能完全转化,故D正确;
故选C.
点评 本题考查化学反应速率以及化学平衡的影响因素,注意相关基础知识的学习和积累,难度不大,注意可逆反应不能完全转化.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
3.等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3③NaHSO4 ④Ba(OH)2,溶液中水的电离程度由大到小排列是( )
| A. | ②>①>③>④ | B. | ①>③>④>② | C. | ②>③>①>④ | D. | ②>③>④>① |
20.某原电池装置图如图所示,有关该原电池的说法正确的是( )
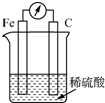

| A. | 在铁棒上产生气泡,碳棒上没有气泡 | |
| B. | H+在溶液中定向流向铁 | |
| C. | 电子由铁电极流出 | |
| D. | 该装置能将电能转化为化学能 |
7.为纪念俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.该元素最稳定的一种原子为${\;}_{101}^{258}$Md,关于该原子下列说法正确的是( )
| A. | 质子数是258 | B. | 质量数是101 | C. | 中子数是157 | D. | 电子数是359 |
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,44gCO2中含有的氧原子数目为2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA |
1.下列有关实验的叙述合理的是( )
| A. | 可用瓷坩埚灼烧氢氧化钠固体 | |
| B. | 中和热测定实验中可用铜制搅拌棒代替玻璃环形搅拌棒 | |
| C. | 用酸式滴定管量取12.00mL高锰酸钾溶液 | |
| D. | 用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小 |