题目内容
3.等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3③NaHSO4 ④Ba(OH)2,溶液中水的电离程度由大到小排列是( )| A. | ②>①>③>④ | B. | ①>③>④>② | C. | ②>③>①>④ | D. | ②>③>④>① |
分析 酸溶液和碱溶液抑制了水的电离,酸溶液中的氢离子、碱溶液中的氢氧根离子浓度越大,水的电离程度越小;能够水解的盐溶液促进了水的电离,水解程度越大,水的电离程度越大,据此进行解答.
解答 解:设四种溶液的物质的量浓度均为c,
①CH3COOH为弱酸,醋酸抑制了水的电离,溶液中氢离子浓度小于c;
②(NH4)2CO3中铵根离子和碳酸根离子都能够水解,促进了水的电离,五种物质中碳酸铵溶液中水的电离程度最大;
③NaHSO4为酸性溶液,溶液中氢离子浓度为c,硫酸氢钠溶液中水的电离程度小于①;
④Ba(OH)2溶液中氢氧根离子浓度为2c,则氢氧化钡溶液中水的电离程度最小;
根据以上分析可知,醋酸溶液中水的电离程度大于③NaHSO4、④Ba(OH)2,小于②,所以四种溶液中水的电离程度由大到小排列为:②①③④,
故选A.
点评 本题考查了水的电离、盐的水解原理及其影响因素,题目难度不大,注意掌握盐的水解原理、水的电离及其影响因素,明确酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离.

练习册系列答案
相关题目
13.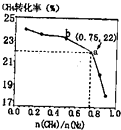 CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
 CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)$?_{催化剂}^{700℃}$3C(s)+4NH3(g)△H>0,700℃时,$\frac{n(C{H}_{4})}{n({N}_{2})}$与CH4的平衡转化率的关系如图所示.下列判断正确的是( )| A. | $\frac{n(C{H}_{4})}{n({N}_{2})}$越大,CH4的转化率越高 | |
| B. | $\frac{n(C{H}_{4})}{n({N}_{2})}$与不变时,升温,NH3的体积分数会减小 | |
| C. | b点对应的平衡常数比a点的大 | |
| D. | a点对应的NH3的体积分数约为13% |
14.下列属于混合物的是( )
| A. | 葡萄糖 | B. | 金刚石 | C. | 冰红茶 | D. | 苛性钠 |
18.材料是人类赖以生存和发展的重要物质基础,有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种( )
| A. | 橡胶 | B. | 纤维 | C. | 塑料 | D. | 玻璃 |
8.下列物质中,属于电解质的是( )
| A. | 水银 | B. | 硝酸钾 | C. | 酒精 | D. | 蔗糖 |
15.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2A1O2-+3H2↑ |
12.2SO2+O2?2SO3△H<0是工业上接触法制硫酸的重要反应.下列关于该反应的说法不正确的是( )
| A. | 增加O2的浓度提高SO2的转化率 | |
| B. | 利用该反应放出的热量对SO2、O2预热 | |
| C. | 降低温度能加快反应的速率 | |
| D. | 即使增大压强也不能使SO2全部转化为SO3 |
13.下列化学用语表述正确的是( )
| A. | HCl的电子式: | B. | 乙烯的比例模型: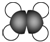 | ||
| C. | 明矾的化学式:KAl(SO4)2 | D. | 间-硝基甲苯的结构简式: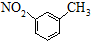 |