题目内容
7.为纪念俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔.该元素最稳定的一种原子为${\;}_{101}^{258}$Md,关于该原子下列说法正确的是( )| A. | 质子数是258 | B. | 质量数是101 | C. | 中子数是157 | D. | 电子数是359 |
分析 根据原子符号中,左下角的数字为质子数,左上角的数字为质量数,中子数=质量数-质子数,质子数=原子序数=核电荷数=核外电子数.
解答 解:A、${\;}_{101}^{258}$Md的质子数是101,故A错误;
B、${\;}_{101}^{258}$Md的质量数是258,故B错误;
C、${\;}_{101}^{258}$Md的质子数是101,质量数为258,中子数=258-101=157,故C正确;
D、${\;}_{101}^{258}$Md的质子数是101,电子数是101,故D错误;
故选C.
点评 本题主要考查了原子符号的含义、中子数=质量数-质子数以及质子数=原子序数=核电荷数=核外电子数,难度不大,根据所学知识即可完成.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
18.材料是人类赖以生存和发展的重要物质基础,有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种( )
| A. | 橡胶 | B. | 纤维 | C. | 塑料 | D. | 玻璃 |
15.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2A1O2-+3H2↑ |
2.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 金属性:D>C | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 |
12.2SO2+O2?2SO3△H<0是工业上接触法制硫酸的重要反应.下列关于该反应的说法不正确的是( )
| A. | 增加O2的浓度提高SO2的转化率 | |
| B. | 利用该反应放出的热量对SO2、O2预热 | |
| C. | 降低温度能加快反应的速率 | |
| D. | 即使增大压强也不能使SO2全部转化为SO3 |
19.下列反应的离子方程式的书写正确的是( )
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42ˉ=BaSO4↓ | |
| C. | 氯化铝溶液与过量氨水反应:Al3++3OH-=Al(OH)3↓ | |
| D. | 常温下,用氢氧化钠溶液吸收多余的氯气:Cl2+2OH-=Cl-+ClO-+H2O |
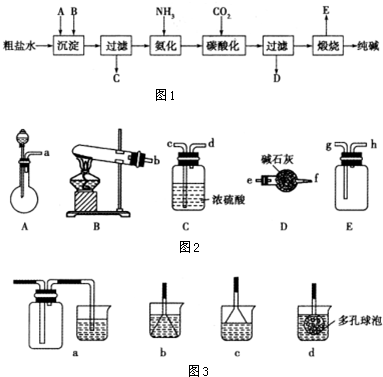
 )是一种重要的工业塑化剂,其合成路线很多,如图就是其中的一种合成方法:
)是一种重要的工业塑化剂,其合成路线很多,如图就是其中的一种合成方法: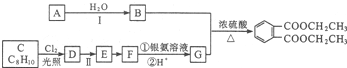
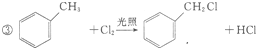
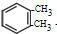 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$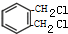 +2HCl.
+2HCl. ;
;