题目内容
【题目】海水是重要的资源,可以制备一系列物质。下列说法不正确的
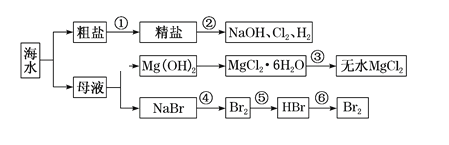
A. 要除去粗盐中SO42、Ca2+、Mg2+等杂质,步骤①中所加试剂及相关操作顺序可以是:过量NaOH溶液→过量BaCl2溶液→过量Na2CO3溶液→过滤→盐酸
B. 步骤②的反应原理为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C. 步骤③中MgCl2·6H2O置于干燥的HCl气流中加热脱水制备无水MgCl2
D. 步骤④、⑤、⑥所涉及的反应中,溴元素均发生氧化反应
【答案】D
【解析】
A. 镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,加入的碳酸钠要放在加入的氯化钡之后,过量的碳酸钠不仅可以除去溶液中的钙离子,也能除去除杂剂中的钡离子,再进行过滤操作,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最终达到目的,A项正确;
B. 根据反应原理已知,步骤②为氯碱工业步骤,B项正确;
C.步骤③氯化镁在水溶液中能水解,加热时由于HCl的挥发会促进水解,晶体直接加热不能获得无水氯化镁,应在氯化氢气流中加热失水,C项正确;
D.步骤④是溴离子被氧化为溴单质,步骤⑤是溴单质被还原为溴化氢,步骤⑥是Br-被氧化为溴单质,D项错误;
答案选D。

练习册系列答案
相关题目