题目内容
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
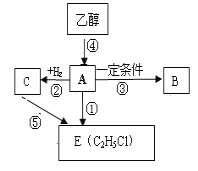
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:

回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
【答案】d c 溴的颜色完全褪去 下 分液 b 冷却可避免溴的大量挥发
【解析】
装置A是乙醇在浓硫酸的存在下在170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致制得的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长玻璃管内液面上升或下降调节装置内压强,根据B中玻璃管中内外液面高低变化,可以判断是否发生堵塞;二氧化碳、二氧化硫等酸性气体能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品;
(1)乙醇在浓硫酸140℃的条件下,发生分子间脱水生成乙醚;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(6)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而堵塞导管。
(1)乙醇在浓硫酸140℃的条件下,发生分子间脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成,选择d;故答案为d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,故选c,故答案为c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有机层在下层,分离时用分液漏斗采用分液操作分离;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故答案为b;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,使溴充分反应。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是____________
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2 的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
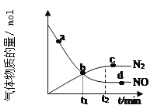
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。
(2) 已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中______(填“吸收”或“放出”)的能量为_______kJ。
(3) 一定条件下,在 5 L密闭容器内,反应 2NO2(g) ![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 内该反应的平均速率为________ molL-1s-1。在第 5s 时,NO2 的转化率为___________。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
③为加快反应速率,可以采取的措施是_______
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2