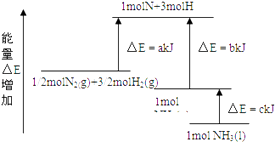
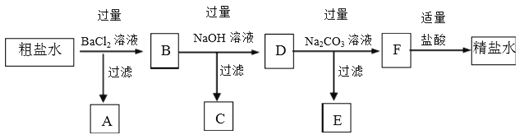
��Ŀ����
����Ŀ����.4.1gH3PO3����2gNaOH��ȫ��Ӧ�������Σ���H3PO3Ϊ__________Ԫ�ᡣ�����εĵ��뷽��ʽΪ_________________��
��С�մ�θ��ƽ����ϲ���dz��õ��к�θ���ҩ�
(1)С�մ�ƬÿƬ��0.504gNaHCO3��2ƬС�մ�Ƭ���к�θ���е�H+��_____mol��
(2)θ��ƽÿƬ��0.234gAl(OH)3���к�θ��ʱ��6ƬС�մ�Ƭ�൱��θ��ƽ__________��
(3)��ϲ�Ļ�ѧ�ɷ�������þ�ļ�ʽ̼���Ρ�ȡ�ü�ʽ�η�ĩ3.01g����μ���2.0mol/L����ʹ���ܽ�(�����ɷֲ������ᷴӦ)������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ____________��
���𰸡� һ NaH2PO3=Na++H2PO3- 0.012 4 16��1
������������4.1gH3PO3�����ʵ�����4.1g��82g/mol��0.05mol��2gNaOH�����ʵ�����2g��40g/mol��0.05mol�����߰������ʵ���֮��1��1��ȫ��Ӧ�������Σ���H3PO3ΪһԪ�ᡣ�����εĵ��뷽��ʽΪNaH2PO3=Na++H2PO3����
������1��С�մ�ƬÿƬ��0.504gNaHCO3��2ƬС�մ�Ƭ��̼�����Ƶ����ʵ�����1.008g��84g/mol��0.012mol��������к�θ���е�H+��0.012mol����2��0.234gAl(OH)3�����ʵ�����0.234g��78g/mol��0.003mol������к�θ��ʱ��6ƬС�մ�Ƭ�൱��θ��ƽ![]() Ƭ����3���йط�Ӧ�ķ���ʽ������NaOH��HCl��NaCl��H2O��HCl��Na2CO3��NaHCO3��NaCl��NaHCO3��HCl��NaCl��H2O��CO2��������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ������̼�������Ӧ��������45mL��42.5mL��2.5mL����������ʵ�����0.005mol������̼����������ʵ�����0.005mol����̼��������ʵ���Ҳ��0.005mol������������̼�����Ӧ������������ʵ�����0.0425L��2mol/L��0.085mol��������������Ӧ��������0.085mol��0.005mol��0.08mol�����������������ʵ�����0.08mol����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ16��1��
Ƭ����3���йط�Ӧ�ķ���ʽ������NaOH��HCl��NaCl��H2O��HCl��Na2CO3��NaHCO3��NaCl��NaHCO3��HCl��NaCl��H2O��CO2��������������42.5mLʱ����ʼ����CO2������������45.0mLʱ���÷�Ӧ��ȫ������̼�������Ӧ��������45mL��42.5mL��2.5mL����������ʵ�����0.005mol������̼����������ʵ�����0.005mol����̼��������ʵ���Ҳ��0.005mol������������̼�����Ӧ������������ʵ�����0.0425L��2mol/L��0.085mol��������������Ӧ��������0.085mol��0.005mol��0.08mol�����������������ʵ�����0.08mol����ü�ʽ����Ʒ����������̼��������ʵ���֮��Ϊ16��1��