题目内容
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ ,滴定曲线如图所示。下列说法错误的是
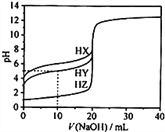
A. HZ是强酸,HX、HY是弱酸
B. 根据滴定曲线,可得Ka(HY)≈10-5
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)+c(Z-)+c(Y-)
【答案】C
【解析】A、0.1000mol·L-1的三种酸HX、HY、HZ中HZ的PH=1,为强酸,其他两种PH大于1,说明不完全电离,为弱酸,选项A正确;B、当NaOH溶液滴到10ml时,溶液中c(HY)≈c(Y-),即Ka(HY)≈c(H+)=10-PH=10-5,选项B正确;C、HX恰好完全反应时,HY早已经完全反应,所得溶液为NaX和NaY混合液,酸性 HX<HX,NaY水解程度小于HX,故溶液中c(X-)<c(Y-),选项C错误;D、HY与HZ混合,溶液中电荷守恒为c(H+)=c(Y-)+c(Z-)+c(OH-),选项D正确。答案选C。

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目