题目内容
【题目】下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合后的溶液:[Cl-]>[NH4+]> [Na+]>[OH-]>[H+]
B. 等物质的量的NaClO、NaHCO3混合溶液中:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+2[CO32-]
C. pH=2的HA溶液与pH=12的NaOH溶液等体积混合:[M+]=[A-]>[OH-]=[H+]
D. 某二元弱酸的酸式盐NaHA溶液中,[OH-]+[H2A]=[H+]+2[A2-]
【答案】A
【解析】A. 0.1mol·L-1的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合后,NH4Cl+NaOH![]() NaCl+NH3·H2O,形成等浓度的NaCl、NH4Cl、NH3·H2O的混合溶液,NH3·H2O的电离程度大于NH4Cl的水解程度,所以[Cl-]>[NH4+]>[Na+]>[OH-]>[H+],故A正确;B. 等物质的量的NaClO、NaHCO3混合溶液中,氯元素和碳元素物质的量相等:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+[CO32-],故B错误;C. 若HA为弱酸,弱酸难电离,HA浓度大于NaOH,则中和反应剩余酸,混合溶液呈酸性,故C错误;D. 某二元弱酸的酸式盐NaHA溶液中,电荷守恒:[Na+]+[H+]=[OH-]+[HA-]+2[A2-],元素守恒:[Na+]=[H2A]+[HA-]+[A2-],两个等式消去[Na+]得[H2A]+[H+]=[OH-]+[A2-],故D错误。故选A。
NaCl+NH3·H2O,形成等浓度的NaCl、NH4Cl、NH3·H2O的混合溶液,NH3·H2O的电离程度大于NH4Cl的水解程度,所以[Cl-]>[NH4+]>[Na+]>[OH-]>[H+],故A正确;B. 等物质的量的NaClO、NaHCO3混合溶液中,氯元素和碳元素物质的量相等:[HClO]+[ClO-]=[HCO3-]+[H2CO3]+[CO32-],故B错误;C. 若HA为弱酸,弱酸难电离,HA浓度大于NaOH,则中和反应剩余酸,混合溶液呈酸性,故C错误;D. 某二元弱酸的酸式盐NaHA溶液中,电荷守恒:[Na+]+[H+]=[OH-]+[HA-]+2[A2-],元素守恒:[Na+]=[H2A]+[HA-]+[A2-],两个等式消去[Na+]得[H2A]+[H+]=[OH-]+[A2-],故D错误。故选A。

【题目】已知:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,1570C时开始分解:
(1)探究草酸的酸性
250C H2C2O4 K1 = 5.4 x 10-2,K2 = 5. 4 x 10 -5 ;H2CO3 K1=4.5x10-7 K2= 4.7X10-11
下列化学方程式可能正确的是________
A. H2C2O4 +CO32-=HCO3- +HC2O4- B. HC2O4- +CO32-= HCO3-+C2O42-
C. 2C2O42-+CO2+H2O=2HC2O4-+CO32- D. H2C2O4 +CO32-=C2O42-+H2O+CO2
(2)探究草酸分解产物
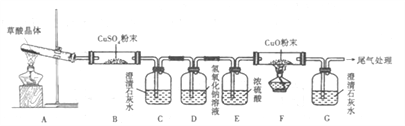
①实验中观察到B中CuSO4粉末变蓝,C中澄清石灰水变浑浊,D的作用:_______,证明有CO气体生成的现象是:_____________________
②写出H2C2O4分解的化学方程式_____________________
(3)探究催化剂对化学反应速率的影响
在甲、乙两支试管中各加人4mLO.O1mol/T. KMnO4酸性溶液和2mL O.1mol/L H2C2O4溶液, 再向乙试管中加人一粒黄豆大的MnSO4固体,摇匀。填写下表:
反应现象 | ______________ |
实验结论 | ______________ |
试管中发送反应的离子方程式 | ______________ |
(4)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度
实验步骤:准确称取2.OgNa2C2O4固体,配成1OO mL溶液,取出20.OOmL于锥形瓶中=再向瓶 中加人足量稀H2SO4 ,用0.0160mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.OOmL0
①高锰酸钾溶液应装在_______滴定管中。(填“酸 式”或“碱 式”)
②滴定至终点时的实验现象是:______________。
③Na2C2O4的纯度是:______________