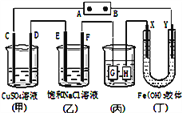
题目内容
【题目】I.在恒温、体积为1.0L的密闭容器中通入1.0molN2和xmolH2发生如下反应N2(g)+3H2(g)![]() 2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
2NH3(g),20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的物质的量为1.6mol,容器内的压强变为原来的80%。请回答下列问题:
(1)20min内,V(N2)=______。
(2)该反应的热化学方程式为____________。
(3)下列叙述中能表示该反应达到平衡状态的是_______(填序号)。
①N2体积分数保持不变
②单位时间断裂03tmolH-H键,同时生成0.6molN-H键
③混合气体的密度不再改变
④2v正(H2)=3v逆(NH3)
⑤混合气体的平均摩尔质量不再改变
II.1883年,瑞典化学家阿伦尼乌斯创立了电离学说,在水溶液范围内对酸、碱作出了严密的概括。请回答下列有关水溶液的问题:
(4)①用电离方程式表示氨水溶液是碱性的原因________;
②用离子方程式表示碳酸钠溶液显碱性的原因__________。
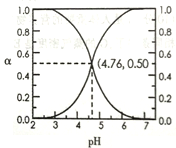
(5)25℃时,在含HA和A-的溶液中,HA和A-两者中各自所占的物质的量分数(a)随溶液pH变化的关系如下图所示。请比较下列大小关系(填编号)
①在pH<4.76的溶液中,c(A-)____(HA);
②在pH>4.76的溶波中,c(A-)+(OH-)_____c(H+)。
A.大于 B.小于 C.等于 D.可能大于,也可能等于 E.可能小于,也可能等于
【答案】 V(N2)=0.010mol/(L·min) N2(g)+3H2(g)![]() 2NH3(g)H=-92kJ/mol ①④⑤ NH3·H2O
2NH3(g)H=-92kJ/mol ①④⑤ NH3·H2O![]() NH4++OH- CO32-+H2O
NH4++OH- CO32-+H2O![]() HCO3-+OH- B D
HCO3-+OH- B D
【解析】设平衡时氮气转化率为a,则
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始的量(mol)1.0 x 0
改变的量(mol)a 3a 2a
平衡的量(mol)1.0-a x-3a 2a
![]() ,解得x=1.0,2.0-2a=1.6,解得a=0.2。(1)20min内,V(N2)=
,解得x=1.0,2.0-2a=1.6,解得a=0.2。(1)20min内,V(N2)=![]() ;(2) 0.2mol氮气参与反应时放出18.4kJ热量,则1mol氮气参与反应时的焓变为-
;(2) 0.2mol氮气参与反应时放出18.4kJ热量,则1mol氮气参与反应时的焓变为-![]() ,该反应的热化学方程式为N2(g)+3H2(g)
,该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)H=-92kJ/mol;(3)根据“变量不变达平衡”进行判断。①反应为气体体积缩小的反应,N2体积分数为变量,当其体积分数保持不变时反应达平衡状态,故正确;②单位时间断裂0.3molH-H键,同时生成0.6molN-H键,都是指正反应速率,无法说明正逆反应速率相等,反应不一定达平衡,故错误;③反应在恒容条件下进行且所有反应物均为气体,密度不是变量,故混合气体的密度不再改变平衡不一定达平衡,故错误;④2v正(H2)=3v逆(NH3),说明正逆反应速率相等,反应达平衡状态,故正确;⑤混合气体的平均摩尔质量为变量,若其不再改变则反应达平衡,故正确。答案选①④⑤;(4)①一水合氨属于弱碱,能部分电离出氢氧根离子,其电离方程式为:NH3·H2O
2NH3(g)H=-92kJ/mol;(3)根据“变量不变达平衡”进行判断。①反应为气体体积缩小的反应,N2体积分数为变量,当其体积分数保持不变时反应达平衡状态,故正确;②单位时间断裂0.3molH-H键,同时生成0.6molN-H键,都是指正反应速率,无法说明正逆反应速率相等,反应不一定达平衡,故错误;③反应在恒容条件下进行且所有反应物均为气体,密度不是变量,故混合气体的密度不再改变平衡不一定达平衡,故错误;④2v正(H2)=3v逆(NH3),说明正逆反应速率相等,反应达平衡状态,故正确;⑤混合气体的平均摩尔质量为变量,若其不再改变则反应达平衡,故正确。答案选①④⑤;(4)①一水合氨属于弱碱,能部分电离出氢氧根离子,其电离方程式为:NH3·H2O![]() NH4++OH-;②碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,水解方程式为CO32-+H2O
NH4++OH-;②碳酸钠为强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,水解方程式为CO32-+H2O![]() HCO3-+OH-;(5)①A.在pH<4.76的溶液显酸性,c(A-)<c(HA),答案选B;②在pH>4.76的溶液中存在电荷守恒,c(A-)+(OH-)可能大于c(H+),若无其他阳离子则可等于,答案选D。
HCO3-+OH-;(5)①A.在pH<4.76的溶液显酸性,c(A-)<c(HA),答案选B;②在pH>4.76的溶液中存在电荷守恒,c(A-)+(OH-)可能大于c(H+),若无其他阳离子则可等于,答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
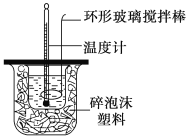
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。