题目内容
【题目】将废旧锌锰电池处理得到含锰混合物,既能减少它对环境的污染,又能实现废电池的资源化利用。
Ⅰ. 回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
(1)写出MnO(OH)与浓盐酸反应的化学方程式:_________。
Ⅱ. 锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH + MnO2 + 2H2C2O4 + 3H2SO4 == 3MnSO4 + 4CO2↑ + 6H2O
(2)与使用浓盐酸回收锰相比,新方法的优点是_________(答1点即可)。
(3)欲以MnSO4溶液为原料制备MnCO3,选用的加料方式___________(填字母),原因是___________。
已知:Ksp(MnCO3)=2.3×10﹣11、Ksp[Mn(OH)2]=2.1×10﹣13
a. 将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b. 将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c. 将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d. 以上三种方式都无法得到MnCO3.
Ⅲ. 现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
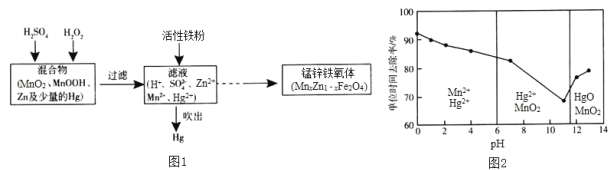
请回答下列问题:
(4)MnxZn1﹣xFe2O4中铁元素化合价为+3,则锰元素的化合价为___________。
(5)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(6)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为__________________。
(7)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如图2所示:
①写出pH=10时KMnO4溶液吸收汞蒸气的离子方程式________________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是__________________。
【答案】(1)2MnO(OH)+6HCl![]() 2MnCl2+Cl2↑+4H2O(2分)
2MnCl2+Cl2↑+4H2O(2分)
(2)反应过程无有毒有害物质生成,不造成二次污染;废物资源化等(2分)
(3)c(1分)避免生成Mn(OH)2(2分)
(4)+2(1分)(5)还原剂(1分)
(6)MnO2+H2O2+2H+=Mn2++O2↑+2H2O(2分)
(7)①3Hg+2MnO4-+4H2O=3Hg2++2MnO2+8OH-(2分)②Mn2+作了催化剂(2分)
【解析】
试题分析:(1)+4价的锰能把浓盐酸氧化为氯气,即MnO(OH)与浓盐酸反应生成氯气和氯化锰、水,其反应方程式为2MnO(OH)+6HCl![]() 2MnCl2+Cl2↑+4H2O;
2MnCl2+Cl2↑+4H2O;
(2)分析回收工艺的优点从可操作性、产品的纯度、对环境的影响等方面分析,可知工艺流程简单;生成CO2和H2O不影响MnSO4纯度;反应过程无有毒有害物质生成,不造成二次污染;废物资源化等;
(3)由Ksp(MnCO3)=2.3×10﹣11、Ksp[Mn(OH)2]=2.1×10﹣13计算可知,调节MnSO4溶液pH至6.0左右,缓慢滴入1Na2CO3溶液,酸性条件下生成MnCO3,而改为向 Na2CO3溶液中缓慢滴加Mn2+溶液,碳酸钠溶液的碱性强,由Ksp可知,先生成Mn(OH)2,选用的加料方式为:将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中,碳酸钠溶液的碱性强,避免先生成Mn(OH)2;
(4)设Mn元素的化合价为y,MnxZn1-xFe2O4中Fe元素为+3价,根据正负化合价的代数和为0,有yx+2(1-x)+3×2-2×4=0,解得y=2,故Mn元素的化合价为+2价;
(5)铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂;
(6)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为MnO2 + H2O2 + 2H+ = Mn2+ + O2↑+ 2H2O;
(7)①写出pH=10时KMnO4溶液吸收汞蒸气的离子方程式3Hg + 2MnO4- + 4H2O = 3Hg2+ + 2MnO2 + 8OH-;
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是Mn2+作了催化剂。