题目内容
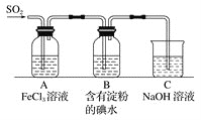
【题目】I.X是一种集洗涤、漂白、杀菌于一体的新型漂白剂(由四种短周期元素组成的纯净物),无毒无味,性能温和,且对环境友好。X从组成形式上可看成是某种正盐M与活性物质N的加合产物(mM·nN ,类似于结晶水合物,相对分子量不超过400)。现将X按如下流程实验,气体A能使带火星的木条复燃,固体B溶于水所得溶液显碱性,且焰色反应呈黄色。

请回答:
(1) X中含有的非金属元素是________,写出X灼烧的化学方程式是_________________。
(2)向X的溶液中通入少量SO2,请写出离子方程式__________________。
II .某化学兴趣小组为了探究硫酸铁溶液与铜粉反应的限度问题,向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,过滤,向滤液中滴加2滴0.2mol/L KSCN溶液。实验现象为:溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。甲同学猜想出现异常现象是由于溶液中的Cu2+干扰了Fe3+的检验,查阅相关资料如下:
①CuSCN是一种白色沉淀物
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
(1)该兴趣小组所记录的实验现象说明铜与铁离子的反应__________(填有或没有)限度。
(2)请用离子方程式分别解释“溶液变为红色”、“振荡后红色迅速褪去并有白色沉淀生成”现象的原因:___________________________________、_________________________________。
(3)为了进一步探究,该小组向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。请解释溶液变红的可能原因(可以不止一种):
①____________,②___________,③_________
【答案】C、H、O 2[2Na2CO3·3H2O2] ![]() 4Na2CO3+6H2O+3O2↑ 2CO
4Na2CO3+6H2O+3O2↑ 2CO![]() + H2O2+ SO2= SO
+ H2O2+ SO2= SO![]() + 2HCO
+ 2HCO![]() 有 Fe3++ 3SCN-= Fe(SCN)3 4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2 Cu2+可以将Fe2+氧化成Fe3+,Fe3+遇SCN-变红 Cu2+氧化SCN-为(SCN)2,(SCN)2可氧化Fe2+氧化成Fe3+,Fe3+遇SCN-变红 ——
有 Fe3++ 3SCN-= Fe(SCN)3 4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2 Cu2+可以将Fe2+氧化成Fe3+,Fe3+遇SCN-变红 Cu2+氧化SCN-为(SCN)2,(SCN)2可氧化Fe2+氧化成Fe3+,Fe3+遇SCN-变红 ——
【解析】
I.干燥管增重1.08g,说明X中含有H元素,生成的水蒸气的物质的量为![]() =0.06mol;固体B溶于水所得溶液显碱性,且焰色反应呈黄色,说明X中含有钠元素;固体B溶解后滴加氯化钙溶液,生成白色沉淀,X是由四种短周期元素组成的纯净物,无毒无味,性能温和,且对环境友好,则该白色沉淀为碳酸钙,说明X中含有C元素,B为Na2CO3;碳酸钙的质量为4.00g,物质的量为
=0.06mol;固体B溶于水所得溶液显碱性,且焰色反应呈黄色,说明X中含有钠元素;固体B溶解后滴加氯化钙溶液,生成白色沉淀,X是由四种短周期元素组成的纯净物,无毒无味,性能温和,且对环境友好,则该白色沉淀为碳酸钙,说明X中含有C元素,B为Na2CO3;碳酸钙的质量为4.00g,物质的量为![]() =0.04mol;则6.28g X中含有0.12molH、0.08molNa、0.04molC;根据质量的关系分析判断是否含有O元素,结合X是某种正盐M与活性物质N的加合产物,且相对分子量不超过400,分析判断X的化学式;
=0.04mol;则6.28g X中含有0.12molH、0.08molNa、0.04molC;根据质量的关系分析判断是否含有O元素,结合X是某种正盐M与活性物质N的加合产物,且相对分子量不超过400,分析判断X的化学式;
II .向一定量的硫酸铁溶液中加入过量的铜粉,充分振荡后溶液逐渐变蓝,说明铁离子被还原生成亚铁离子,铜被氧化得到铜离子,发生反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+;过滤,向滤液中滴加2滴0.2mol/L KSCN溶液,溶液变为红色,说明溶液中含有Fe3+,振荡后红色迅速褪去并有白色沉淀生成,是因为生成了CuSCN白色沉淀,据此分析解答。
I.根据上述分析,6.28g X中含有0.12molH、0.08molNa、0.04molC;0.12molH、0.08molNa、0.04molC的质量之和为0.12mol×1g/mol+0.08mol×23g/mol+0.04mol×12g/mol=2.44g<6.28g,说明X中含有O元素,且质量=6.28g-2.44g=3.84g,物质的量为![]() =0.24mol,X中N(Na)∶N(C)∶N(H)∶N(O)= 0.08mol∶0.04mol∶0.12mol∶0.24mol= 2∶1∶3∶6,X从组成形式上可看成是某种正盐M与活性物质N的加合产物,气体A能使带火星的木条复燃,气体A为氧气且其物质的量为0.03mol,则M为Na2CO3,N为H2O2,6.28gX中含有0.04mol Na2CO3,0.06mol H2O2,相对分子量不超过400,则X的化学式为2Na2CO3·3H2O2。
=0.24mol,X中N(Na)∶N(C)∶N(H)∶N(O)= 0.08mol∶0.04mol∶0.12mol∶0.24mol= 2∶1∶3∶6,X从组成形式上可看成是某种正盐M与活性物质N的加合产物,气体A能使带火星的木条复燃,气体A为氧气且其物质的量为0.03mol,则M为Na2CO3,N为H2O2,6.28gX中含有0.04mol Na2CO3,0.06mol H2O2,相对分子量不超过400,则X的化学式为2Na2CO3·3H2O2。
(1) X中含有的非金属元素是C、H、O,X灼烧生成碳酸钠,水和氧气,反应的化学方程式为2[2Na2CO3·3H2O2] ![]() 4Na2CO3+6H2O+3O2↑,故答案为:C、H、O;2[2Na2CO3·3H2O2]
4Na2CO3+6H2O+3O2↑,故答案为:C、H、O;2[2Na2CO3·3H2O2] ![]() 4Na2CO3+6H2O+3O2↑;
4Na2CO3+6H2O+3O2↑;
(2)过氧化氢具有氧化性,能够氧化二氧化硫,向X的溶液中通入少量![]() + H2O2+ SO2= SO
+ H2O2+ SO2= SO![]() + 2HCO
+ 2HCO![]() ,故答案为:2CO
,故答案为:2CO![]() + H2O2+ SO2= SO
+ H2O2+ SO2= SO![]() + 2HCO
+ 2HCO![]() ;
;
II .(1)根据上述分析,一定量的硫酸铁溶液中加入过量的铜粉,反应后的溶液中还含有Fe3+,说明铜与铁离子的反应有限度,故答案为:有;
(2)向滤液中滴加2滴0.2mol/L KSCN溶液,溶液变为红色,说明溶液中含有Fe3+,反应的离子方程式为Fe3++ 3SCN-= Fe(SCN)3;振荡后红色迅速褪去并有白色沉淀生成,是因为生成了CuSCN白色沉淀,硫氰[(SCN)2]的性质与卤素单质相似,其氧化性介于Br2和I2之间,说明Fe3+不能与(SCN)2发生氧化还原反应,反应的离子方程式为4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2,故答案为:Fe3++ 3SCN-= Fe(SCN)3;4Fe(SCN)3 + 6Cu2+= 4Fe3++ 6CuSCN↓ + 3(SCN)2;
(3)向盛有2mL 0.5mol/L FeSO4和0.2mol/L KSCN混合溶液的试管中,滴加5滴0.05mol/L硫酸铜溶液,有白色沉淀生成,且溶液变红。白色沉淀为CuSCN;溶液变红是因为溶液中存在了Fe3+,Fe3+遇SCN-变红,出现Fe3+可能是Cu2+将Fe2+氧化成Fe3+,也可能是硫氰[(SCN)2]将亚铁离子氧化生成铁离子等,故答案为:Cu2+可以将Fe2+氧化成Fe3+,Fe3+遇SCN-变红;Cu2+氧化SCN-为(SCN)2,(SCN)2可氧化Fe2+氧化成Fe3+,Fe3+遇SCN-变红。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】在一定温度下,10mL 0.40mol/L H2O2 溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:υ(H2O2)=3.3×10-2mol/(L·min)
B.6~10min的平均反应速率:υ(H2O2)<3.3×10-2mol/(L·min)
C.反应到6min时,c(H2O2)=0.30mol/L
D.反应到6min时,H2O2 分解了50%