题目内容
1.稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素.回答下列问题;(1)钪(Sc)元素的原子核外电子排布式为1s22s22p63s23p63d14s2.钬(Ho)的基态原子电子排布式为[Xe]4f116s2,一个基态钛原子所含的未成对电子数为2.
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数据判断表中最有可能有+4价的元素是Ce.
几种稀土元素的电离能(单位:kJ•mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点.则PrO2(二氧化镨)的晶胞中有8个氧原子.
(6)Ce(铈)单质为面心立方晶体,晶胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12,列式表示Ce(铈)单质的密度:$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$g•cm-3(不必计算出结果)
分析 (1)钪为21号元素,核外电子层排布为2、8、9、2,钛为22号元素,核外电子层排布为2、8、10、2,据此答题;
(2)第四电离能与第一电离能、第二电离能、第三电离能相差越小,第四个电子越容易失去,+4价的可能性越大,根据表中数据判断;
(3)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键.
(4)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键;
(5)CaF2晶胞如图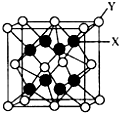 中,则图中Y为镨原子,X为氧原子,据此判断晶胞中氧原子数;
中,则图中Y为镨原子,X为氧原子,据此判断晶胞中氧原子数;
(6)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,根据ρ=$\frac{m}{V}$可求得密度.
解答 解:(1)钪为21号元素,核外电子层排布为2、8、9、2,电子排布式为1s22s22p63s23p63d14s2,钛为22号元素,电子排布式为1s22s22p63s23p63d24s2,故未成对电子数为2,
故答案为:1s22s22p63s23p63d14s2;2;
(2)第四电离能与第一电离能、第二电离能、第三电离能相差越小,第四个电子越容易失去,+4价的可能性越大,在上述表中Ce的I1+I2+I3和I4最接近,故应为Ce元素,
故答案为:Ce;
(3)离子化合物 Na3[Sc(OH)6]中含有羟基与Sc的配位键,羟基中的氢氧元素之间的共价键,故答案为:共价键和配位键;
(4)在ICH2CH2I分子中碳原子只形成了单键,有四个单键,故碳原子杂化轨道类型为sp3;1个CH2=CH2分子中含有5个σ键,故1mol CH2=CH2中含有的σ键数目为5NA,
故答案为:sp3;5NA;
(5)在晶胞 中,Y为镨原子,X为氧原子,可以看到氧原子在晶胞的内部,故此晶胞中应有8个氧原子,故答案为:8;
中,Y为镨原子,X为氧原子,可以看到氧原子在晶胞的内部,故此晶胞中应有8个氧原子,故答案为:8;
(6)Ce(铈)单质为面心立方晶体,以晶胞顶点的铈原子为例,与之距离最近的铈原子分布在经过该顶点的所有立方体的面心上,这样的面有12个,晶胞中铈原子位于顶点和面心,数目为8×1/8+6×1/2=4,该晶胞体积为a3,该晶胞的质量为4M/NA,根据ρ=$\frac{m}{V}$可知,密度为4M/NA×a3g•cm-3,即为$\frac{\frac{4×M}{{N}_{A}}}{{a}^{3}}$=$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$g•cm-3,
故答案为:12;$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10}){\;}^{3}}$.
点评 本题主要考查了核外电子排布、电离能、化学键、晶胞的结构和晶胞的计算等知识,中等难度,答题时注意物质结构的基础知识的灵活运用.

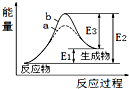
| A. | 该反应为放热反应 | |
| B. | b表示的有催化剂 | |
| C. | 催化剂能降低正、逆反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
| | X | | Y | |
| R |
| A. | 五种元素中原子半径最大的是W,离子半径最大的是R离子 | |
| B. | X、R、W三种元素的最高价氧化物所对应的水化物的酸性强弱关系为R>W>X | |
| C. | Y与Z形成的化合物一定是碱性氧化物 | |
| D. | Z与W形成的化合物水溶液可能显酸性 |
| A. | 原子半径r(X)<r(Y),离子半径r(X-)>r(Y2+) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Z是活泼的金属,其最高价氧化物对应的水合物为强碱 |
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | X表示HA,Y表示OH,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
| A. | Cl2(HCl):饱和食盐水 | B. | H2(H2S、HCl、H2O):碱石灰 | ||
| C. | SO2(HCl):Na2SO3溶液 | D. | CO2(H2S):CuSO4溶液 |
| A. | 氧化剂和还原剂的物质的量之比2:3 | |
| B. | AuS-既作氧化剂又作还原剂 | |
| C. | 每生成2.24 L气体,转移电子数为0.1mol | |
| D. | 反应后溶液的pH值降低 |
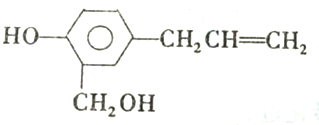 对该物质的性质判断正确的是( )
对该物质的性质判断正确的是( )| A. | 等量A分别与Na和NaOH反应消耗二者的物质的量相同 | |
| B. | 1 mol A 可与2 mol Br2发生取代反应 | |
| C. | A与Na2CO3反应可放出CO2 | |
| D. | 1 mol A 可与4 mol H2发生反应 |