题目内容
16.甲烷既是一种清洁燃料,又是一种重要的化工原料.(1)已知:CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-802.6kJ/mol;
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ/mol;
2CO(g)+O2(g)?2CO2(g)△H=-566.0kJ/mol.
写出CH4与CO2反应生成CO和2molH2的热化学方程式CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.4kJ/mol.
(2)将2molCH4(g)和2molH2O(g)充入某密闭容器中发生反应CH4(g)+H2O(g)?CO(g)+3H2(g),测得CH4的平衡转化率(a)随温度(T)和压强(P)变化的曲线如图所示:
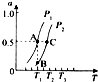
①反应CH4(g)+H2O?CO(g)+3H2(g)的△H>0(填“<”、“>”或“=”);
②图中A、B、C三点的正反应速率[v(A)、v(B)、v(C)]由大到小顺序为v(C)>v(B)>v(A),理由是因为A、B两点对应温度相同,B、C两点对应的压强相同,且P1<P2,T(C)>T(A),温度越高,压强越大,反应速率越大,故v(C)>v(B)>v(A);
③若A点时,测得容器的体积为1L,则T1℃时B点的平衡常数K(B)=27;
④比较图中A、C两点平衡常数[K(A)、K(C)]的大小;K(A)<K(C),(填“<”、“>”或“=”),理由是因C点的温度比A点温度高,且该反应的△H>0,则温度越高平衡常数越大,故有K(A)<K(C).
(3)有人设计用甲烷碱性燃料电池电解饱和食盐水,当阴极产生8.96L气体(标准状况,下同)时,理论上消耗甲烷的体积为2.24L.
分析 (1)已知:CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-802.6kJ/mol ①;
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ/mol ②;
2CO(g)+O2(g)?2CO2(g)△H=-566.0kJ/mol ③;
根据盖斯定律:①+2×②-2×③得到CH4(g)+CO2(g)?2CO(g)+2H2(g)据此计算;
(2)①由图象可知升高温度,甲烷的转化率增大;
②根据温度压强对反应速率的影响分析;
③A、B两点温度相同,则平衡常数相同,A点时甲烷的转化率已知,利用三段式求出平衡时各物质的浓度,在求出平衡常数;
④该反应为吸热反应,温度越高,K越小;
(3)电解饱和食盐水时阴极生成氢气,根据得失电子守恒,燃料电池中甲烷失去的电子数等于生成氢气得到的电子数.
解答 解:(1)已知:CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-802.6kJ/mol ①;
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ/mol ②;
2CO(g)+O2(g)?2CO2(g)△H=-566.0kJ/mol ③;
根据盖斯定律:①+2×②-2×③得到CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=-802.6kJ/mol+2×(-41.0kJ/mol)-2×(-566.0kJ/mol)=+247.4kJ/mol;
故答案为:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.4kJ/mol;
(2)①由图象可知升高温度,甲烷的转化率增大,则升高温度平衡正向移动,所以正方向为吸热反应,即△H>0;
故答案为:>;
②该反应为体积增大的反应,压强越大,甲烷的转化率越小,相同温度T1时,P1对应的转化率大,则压强P1<P2,所以C点对应的温度和压强均高,所以C的速率增大,A、B两点对应的温度相同,B点的压强高,则v(B)>v(A),所以v(C)>v(B)>v(A);
故答案为:v(C)>v(B)>v(A);因为A、B两点对应温度相同,B、C两点对应的压强相同,且P1<P2,T(C)>T(A),温度越高,压强越大,反应速率越大,故v(C)>v(B)>v(A);
③A、B两点温度相同,则A、B两点的平衡常数相同,A点时甲烷的转化率为0.5,
CH4(g)+H2O(g) CO(g)+3H2(g),
CO(g)+3H2(g),
开始(mol/L):2 2 0 0
变化(mol/L):1 1 1 3
平衡(mol/L):1 1 1 3
则平衡常数k=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{1×{3}^{3}}{1×1}$=27;
故答案为:27;
④该反应为吸热反应,升高温度,平衡正向移动,则平衡常数K会增大,已知C点的温度比A点温度高,所以K(A)<K(C);
故答案为:<;因C点的温度比A点温度高,且该反应的△H>0,则温度越高平衡常数越大,故有K(A)<K(C);
(3)甲烷碱性燃料电池电解饱和食盐水,当阴极产生8.96L气体(标准状况,下同)时,电解饱和食盐水时阴极生成氢气,即生成氢气为$\frac{8.96L}{22.4L/mol}$=0.4mol,由失电子守恒,燃料电池中甲烷失去的电子数等于生成氢气得到的电子数,
设消耗的甲烷为nmol,则8×n=0.4mol×2,则n=0.1mol,所以V(CH4)=nVm=0.1mol×22.4L/mol=2.24L;
故答案为:2.24.
点评 本题考查了盖斯定律的应用、化学平衡常数的计算、化学平衡的影响因素及化学平衡图象等,题目综合性较大,侧重于考查学生对基础知识的综合应用能力和计算能力,难度中等,注意控制变量法与定一议二原则应用.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 氧化剂和还原剂的物质的量之比2:3 | |
| B. | AuS-既作氧化剂又作还原剂 | |
| C. | 每生成2.24 L气体,转移电子数为0.1mol | |
| D. | 反应后溶液的pH值降低 |
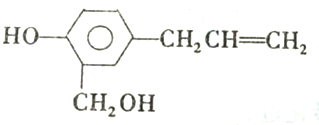 对该物质的性质判断正确的是( )
对该物质的性质判断正确的是( )| A. | 等量A分别与Na和NaOH反应消耗二者的物质的量相同 | |
| B. | 1 mol A 可与2 mol Br2发生取代反应 | |
| C. | A与Na2CO3反应可放出CO2 | |
| D. | 1 mol A 可与4 mol H2发生反应 |
(1)探究碱金属从锂到铯金属性的递变规律,通常设计Na、K单质与水反应对比来说明.请描述K与水反应的现象钾迅速熔化成一小球,四处游动,发出轻微爆炸声,有紫色火焰产生,反应的化学方程式为2K+2H2O=2KOH+H2↑,比Na跟水反应更剧烈.
(2)探究卤素从F到I的非金属性的递变规律
某学生设计了如下的实验方案,请帮助该学生整理并完成实验报告.
①实验用品
仪器:试管、胶头滴管
药品:新制的氯水、氯化钠溶液、溴化钠溶液、KI溶液、四氯化碳
②实验内容(在下表留空的格中填写相关内容)
| 步骤 | 实验方案 | 实验现象(描述最后的) | 离子方程式 |
| ① | 先向试管中加入溴化钠溶液2ml,再加入4-5滴新制氯水,振荡后分两份,取一份又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为橙色 | Cl2+2Br-=Br2+2Cl- |
| ② | 取少量KI溶液于试管,加入几滴步骤①留下的另一份溶液,振荡,又加入CCl4,振荡、静置 | 上层为浅黄色(或无色),下层为紫红色 | Br2+2I-=I2+2Br- |
| 结论 | 氧化性:Cl2>Br2>I2(非金属性:Cl>Br>I) | ||
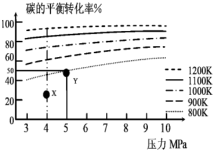 煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )
煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入a molH2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )| A. | 上述逆反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为$\frac{V}{a}$ | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者氢气的转化率高 |
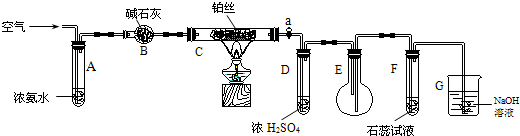
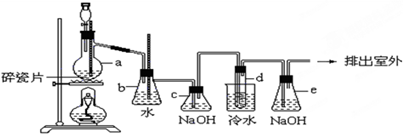
| A. | C不需要持续加热 | |
| B. | D的作用是干燥气体 | |
| C. | B是无用装置 | |
| D. | 仅用该套装置和药品无法达到检验产物的目的 |
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 | |
| C. | 总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物是同系物 |