��Ŀ����
17��T��ʱ�����ݻ��㶨���ܱ�������A������B���巴Ӧ����C���壬��Ӧ������A��B��CŨ�ȵı仯��ͼa��ʾ�������������������䣬�¶ȷֱ�ΪT1��T2ʱ��B������ٷֺ�����ʱ��Ĺ�ϵ��ͼb��ʾ�������н�����ȷ������������
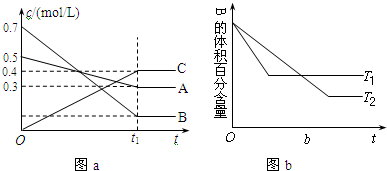
| A�� | �����������䣬�����¶ȣ������淴Ӧ���ʾ�������A��ת�������� | |
| B�� | T��ʱ�����ڸ���������0.4mol/LA��0.4mol/LB��0.2mol/LC��Ӧ���ﵽƽ���C��Ũ����Ϊ0.4mol/L | |
| C�� | �ڣ�t1+10��minʱ�����������������䣬����ѹǿ��ƽ�����淴Ӧ�����ƶ� | |
| D�� | ��t1+10��minʱ������ѹǿ���䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ� |
���� �÷�Ӧ�ﵽƽ��״̬ʱ��AŨ�ȵı仯��=��0.5-0.3��mol/L=0.2mol/L��BŨ�ȵı仯��=��0.7-0.1��mol/L=0.6mol/L��CŨ�ȵı仯��=��0.4-0��mol/L=0.4mol/L��ͬһ��ѧ��Ӧͬһʱ����ڣ�������Ũ�ȵı仯��֮�ȵ����������֮�ȣ����Ը÷�Ӧ����ʽΪ��A��g��+3B��g��?2C��g����
���ݡ��ȹ���ƽ��ֵ���ͼII֪��T1��T2�������¶ȣ�B���������������÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ��
A�����ݡ��ȹ���ƽ��ֵ���ͼ��֪��T1��T2�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
B���ȸ���ͼ�����ƽ�ⳣ�����ٸ���ƽ�ⳣ������ı��������ʵ�Ũ�ȴﵽƽ��״̬ʱC��Ũ�ȣ�
C������ѹǿ��ƽ�������������С�ķ����ƶ���
D�������������䣬�����¶ȣ����淴Ӧ���ʶ�����ƽ�������ȷ�Ӧ�����ƶ���
��� �⣺��Ӧ�ﵽƽ��״̬ʱ��AŨ�ȵı仯��=��0.5-0.3��mol/L=0.2mol/L��BŨ�ȵı仯��=��0.7-0.1��mol/L=0.6mol/L��CŨ�ȵı仯��=��0.4-0��mol/L=0.4mol/L��ͬһ��ѧ��Ӧͬһʱ����ڣ�������Ũ�ȵı仯��֮�ȵ����������֮�ȣ����Ը÷�Ӧ����ʽΪ��A��g��+3B��g��?2C��g����
���ݡ��ȹ���ƽ��ֵ���ͼ��֪��T1��T2�������¶ȣ�B���������������÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ��
A�������������䣬�����¶ȣ����淴Ӧ���ʶ�����ƽ�������ȷ�Ӧ�����ƶ�������ͼ��֪������Ӧ�Ƿ��ȷ�Ӧ������ƽ�����淴Ӧ�����ƶ���A��ת���ʽ��ͣ���A����
B������ͼ��֪����ѧƽ�ⳣ��K=$\frac{��0.4��{\;}^{2}}{0.3����0.1��{\;}^{3}}$=$\frac{1600}{3}$��
����C��ƽ��Ũ����0.4mol/L��
A��g��+3B��g��?2C��g��
��ʼ��mol/L��0.4 0.4 0.2
��Ӧ��mol/L��0.1 0.3 0.2
ƽ�⣨mol/L�� 0.3 0.1 0.4
��ѧƽ�ⳣ��K��=$\frac{��0.4��{\;}^{2}}{0.3����0.1��{\;}^{3}}$=$\frac{1600}{3}$�����Է���ƽ�ⳣ��K����B��ȷ��
C���÷�Ӧ������Ӧ�����������С�ķ�Ӧ����t1+10��minʱ��������������������״̬���䣬����ѹǿ����ѧƽ��������Ӧ�����ƶ�����C����
D����t1+10��minʱ������ѹǿ���䣬ͨ��ϡ�����壬����������Ӧ����ռ��ѹ��С��ƽ�����������ķ����淴Ӧ�����ƶ�����D����
��ѡ��B��
���� ���⿼����������Ի�ѧƽ���ƶ���Ӱ�죬��ȷȷ����Ӧ����ʽ�ǽⱾ��ؼ�������ݡ��ȹ���ƽ��ֵ��ȷ���÷�Ӧ�����ȷ�Ӧ���Ƿ��ȷ�Ӧ���Ѷ��еȣ�

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�| A | B | |
| C | D |
a������99.7kJ b������29.7kJ c���ų�20.6kJ d���ų�241.8kJ
��2��DB2ͨ�����й������̿��ƻ���ҵԭ��H2DB4�������ԴH2��
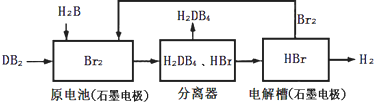
�ٲ�ã�
| ��ѧ�� | H-H | Br-Br | H-Br |
| ���ܣ�kJ/mol�� | 436 | 194 | 362 |
�ڸ������ϣ�
| ��ѧʽ | Ag2SO4 | AgBr |
| �ܽ�ȣ�g�� | 0.796 | 8.4��10-6 |
����ԭ����У����������ķ�ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
���ڵ������У���������������ҺpH�����������С�����䡱����
�ݽ��ù����������ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪ��SO2+2H2O=H2+H2SO4�����������յ��ŵ�
�������ѭ�����ã���������Դ��������һ�㼴�ɣ���ȱ�������ɹ������ж����ʣ����ѭ����Դ���Ĵ�һ�㼴�ɣ���
��3���弰�仯����㷺Ӧ����ҽҩ��ũҩ����ά��������ȼ���ȣ��ش��������⣺��ˮ��������У���Ũ���ĺ�ˮ��ͨ��Cl2�������е�Br-���������ÿ��������壻Ȼ����̼������Һ�����壬���绯ΪBr-��BrO3-�������ӷ���ʽΪBr2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-��
��4��CuBr2�ֽ���Ȼ�ѧ����ʽΪ��2CuBr2��s��=2CuBr��s��+Br2��g����H=+105.4kJ/mol�����ܱ������н�����CuBr2��487K�¼��ȷֽ⣬ƽ��ʱP��Br2��Ϊ4.66��103 Pa��
���練Ӧ��ϵ��������䣬��߷�Ӧ�¶ȣ���p��Br2������������������䡱����С������
���練Ӧ�¶Ȳ��䣬����Ӧ��ϵ���������һ������p��Br2���ı仯��ΧΪ2.33��103 Pa��p��Br2����4.66��103 Pa��
| A�� | ����һ��������ˮ�Ļ�ɫ���� | |
| B�� | SO2����ˮ����H2SO4 | |
| C�� | ������������Һ��������SO2��β�� | |
| D�� | ŨH2SO4���ȶ��������ֽ� |
| A�� | ��Ͷ�������� | B�� | Һ̬ˮ���ˮ���� | ||
| C�� | ����ʯ��ʯ������ʯ�ҺͶ�����̼ | D�� | �����ӱ����ԭ�� |
| A�� | �۱�ϩ�Ľṹ��ʽ��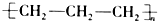 | B�� | ������ӵı���ģ�ͣ�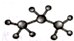 | ||
| C�� | ȩ���ĵ���ʽ�� | D�� | �������ױ��Ľṹ��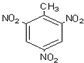 |
| A�� | C60 | B�� | CaCl2 | C�� | KF | D�� | C4H10 |
| A�� | $\frac{m}{16}$ | B�� | 16m | C�� | $\frac{m}{32}$ | D�� | 32m |
| A�� | Zn��s��+CuSO4��aq���TZnSO4��aq��+Cu��s����H=-216kJ•mol-1����Ӧ���������������������� | |
| B�� | ��ͬ�����£����1mol��ԭ�������е�����ΪE1��1mol ����������е�����ΪE2����2E1=E2 | |
| C�� | 101 kPaʱ��2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ•mol-1����H2��ȼ����Ϊ��H=-571.6 kJ•mol-1 | |
| D�� | H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ•mol-1����1molNaOH���������ƹ����뺬0.5molH2SO4��ϡ�����Ϻ�ų�57.3kJ������ |
 ����Ҫ��ش��������⣺
����Ҫ��ش��������⣺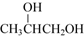 +O2$��_{��}^{Cu}$
+O2$��_{��}^{Cu}$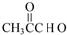 +2H2O��
+2H2O��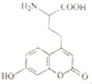 1molNaOH��Һ��Ӧ�������4molNaOH��1mol�����������ӳɷ�Ӧ������1molBr2��
1molNaOH��Һ��Ӧ�������4molNaOH��1mol�����������ӳɷ�Ӧ������1molBr2��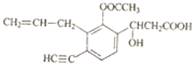 �÷�����һ���뱽������ͬһƽ���̼ԭ����4���������������ϵ�̼ԭ�ӣ��������к���2��˫����
�÷�����һ���뱽������ͬһƽ���̼ԭ����4���������������ϵ�̼ԭ�ӣ��������к���2��˫����