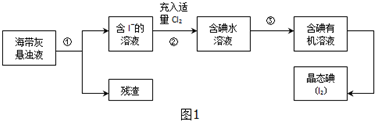
题目内容
11.16.4g某二价金属的硝酸盐M(NO3)2中含有0.2mol NO3-离子,M(NO3)2的摩尔质量是164g/mol,相对分子质量是164,A的相对原子质量是40.分析 依据M(NO3)2~2NO3-,计算M(NO3)2的物质的量,依据M=$\frac{m}{n}$计算解答,摩尔质量以g/mol为单位数值与相对原子质量相同,据此解答.
解答 解:16.4g某二价金属的硝酸盐M(NO3)2中含有0.2mol NO3-离子,
即:M(NO3)2~2NO3-,
1 2
n 0.2mol
解得n=0.1mol,则M=$\frac{16.4g}{0.1mol}$=164g/mol,所以其相对分子质量为164,
设A的相对原子质量为x,则x+2×62=164,解得x=40,
故答案为:164g/mol; 164; 40.
点评 本题考查了物质的量的有关计算,明确以物质的量为中心的计算公式、明确摩尔质量的概念是解题关键,题目难度不大.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
2.下列物质属于共价化合物的是( )
| A. | C60 | B. | CaCl2 | C. | KF | D. | C4H10 |
6.1g O2中含有m个分子,则阿伏加德罗常数的值用m可表示为( )
| A. | $\frac{m}{16}$ | B. | 16m | C. | $\frac{m}{32}$ | D. | 32m |
3.如图是高温下某反应的微观过程.下列说法中正确的是( )
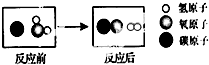

| A. | 该反应属于复分解反应 | B. | 该反应中元素的化合价没有变化 | ||
| C. | 图中的两种化合物都属于氧化物 | D. | 该反应所得生成物的质量比为1:1 |
20.下列各组元素中,按最高正化合价递增顺序排列的是( )
| A. | C、N、F | B. | Na、Mg、Al | C. | F、Cl、Br | D. | Cl、S、P |
1.将CaCl2和CaBr2的混合物13.400g溶于水配成500.00mL溶液,再通入过量的Cl2,完全反应后将溶液蒸干,得到干燥固体11.175g.则原配溶液中c(Ca2+):c(Cl-):c(Br-)为( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 2:3:1 |