题目内容
14.向含有H2SO4的H2O2溶液中滴加一定量的KMnO4 溶液,反应开始时,溶液中c(Mn2+)将随时间的变化而变化.某学生在做实验前认为,c(Mn2+)与时间的关系如图①所示,做完实验后,得到的结果为图②所示.请说明下列问题: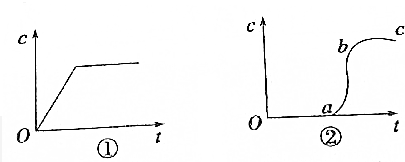
(1)写出H2O2与KMnO4溶液反应的化学方程式:5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑;
(2)Oa段的意义:Oa段说明反应非常慢,溶液中c(Mn2+)随时间变化很小;
(3)ab段的意义及ab段很陡的原因:ab段说明反应非常快,c(Mn2+)迅速增大,表明Mn2+达到一定浓度时,对上述反应起到了催化作用;
(4)bc段的意义:bc段反应接近完全,溶液中c(Mn2+)为定值.
分析 (1)酸性高锰酸钾能够氧化过氧化氢生成锰离子和氧气;
影响化学反应速率的外界因素有温度、浓度、压强、催化剂以及固体的接触面积等等,Oa段锰离子浓度几乎无变化,说明反应很慢,ab段反应速率迅速加快,说明生成物中有反应的催化剂,bc段反应接近完全,锰离子浓度不变,据此分析(2)(3)(4).
解答 解:(1)酸性高锰酸钾能够氧化过氧化氢生成氧气,本身被还原为锰离子,反应的化学方程式为5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑,
故答案为:5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑;
(2)影响化学反应速率的外界因素有温度、浓度、压强、催化剂以及固体的接触面积等等,Oa段锰离子浓度几乎无变化,说明反应很慢,
故答案为:Oa段说明反应非常慢,溶液中c(Mn2+)随时间变化很小;
(3)ab段反应速率迅速加快,说明生成物中有反应的催化剂,ab段说明反应非常快,c(Mn2+)迅速增大,表明Mn2+达到一定浓度时,对上述反应起到了催化作用,
故答案为:ab段说明反应非常快,c(Mn2+)迅速增大,表明Mn2+达到一定浓度时,对上述反应起到了催化作用;
(4)bc段反应接近完全,锰离子浓度不变,溶液中c(Mn2+)为定值,故答案为:bc段反应接近完全,溶液中c(Mn2+)为定值.
点评 本题考查了氧化还原反应方程式书写以及影响化学反应速率的因素,题目难度不大,注意从影响化学反应速率的外界因素只有温度、浓度、压强、催化剂以及固体的接触面积考虑.

练习册系列答案
相关题目
4.一定条件下的密闭容器内发生4NH3+5O2?4NO+6H2O的反应,下列反应速率关系正确的是( )
| A. | V${\;}_{N{H}_{3}}$=$\frac{4}{5}$V${\;}_{{O}_{2}}$ | B. | V${\;}_{N{H}_{3}}$=V${\;}_{{O}_{2}}$=V${\;}_{{H}_{2}O}$ | ||
| C. | V${\;}_{{O}_{2}}$=$\frac{4}{5}$VNO | D. | V${\;}_{{O}_{2}}$=$\frac{6}{5}$V${\;}_{{H}_{2}O}$ |
5.下列过程中放出热量的是( )
| A. | 铝投入盐酸中 | B. | 液态水变成水蒸气 | ||
| C. | 煅烧石灰石生成生石灰和二氧化碳 | D. | 氧分子变成氧原子 |
2.下列物质属于共价化合物的是( )
| A. | C60 | B. | CaCl2 | C. | KF | D. | C4H10 |
6.1g O2中含有m个分子,则阿伏加德罗常数的值用m可表示为( )
| A. | $\frac{m}{16}$ | B. | 16m | C. | $\frac{m}{32}$ | D. | 32m |
3.如图是高温下某反应的微观过程.下列说法中正确的是( )
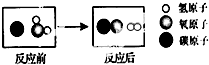

| A. | 该反应属于复分解反应 | B. | 该反应中元素的化合价没有变化 | ||
| C. | 图中的两种化合物都属于氧化物 | D. | 该反应所得生成物的质量比为1:1 |
4.某组成为C3H5O2C1的纯净有机物A与Na0H水溶液共热,产物酸化后可得到分子组成为C3H6O3的有机物B,在适当条件下,每两分子的B可相互发生酯化反应,生成1分子C,那么C的结构不可能是( )
| A. | CH3CH(OH)C00CH(CH3)C00H | B. | CH3CH(OH)C00CH2CH2C00H | ||
| C. | 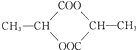 | D. | 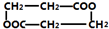 |
 根据要求回答下列问题:
根据要求回答下列问题: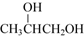 +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$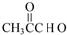 +2H2O.
+2H2O.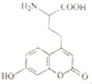 1molNaOH溶液反应最多消耗4molNaOH,1mol该物质因发生加成反应可消耗1molBr2.
1molNaOH溶液反应最多消耗4molNaOH,1mol该物质因发生加成反应可消耗1molBr2.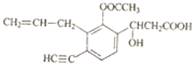 该分子中一定与苯环处于同一平面的碳原子有4个(不包括苯环上的碳原子),分子中含有2种双键.
该分子中一定与苯环处于同一平面的碳原子有4个(不包括苯环上的碳原子),分子中含有2种双键.